SCHEIKUNDIGE REACTIES
Inleiding
De eerste zes modules van deze cursus gaan over stoffen en hun eigenschappen, terwijl vanaf deze module 7 de aandacht gaat naar hoe die stoffen en hun eigenschappen veranderingen kunnen ondergaan. Anders gezegd: hoe stoffen reageren.
In een chemische reactie heb je reagentia die producten vormen, dus nieuwe stoffen met nieuwe eigenschappen.
Vaak worden natuurkundige veranderingen, zoals verdampen, tijdelijk genoemd en scheikundige veranderingen, zoals in reacties, blijvend.
Let wel, niet altijd is het onderscheid zo eenvoudig te maken.
De onderwerpen van deze module zijn:
gedrag van deeltjes bij een chemische reactie, de reactievergelijking, reactieberekeningen, energie en energiediagrammen, de reactiesnelheid en de verschillende reactietypes.
Opdracht 1
Als je aardappelen kookt, vinden er diverse processen plaats. Leg uit welke processen dat zijn.
Opdracht 2
Het oplossen van zout in water is een natuurkundige of een scheikundige verandering?
Leg je antwoord uit.
Antwoord 07-02
Opdracht 3
Bedenk een paar chemische reacties die misschien al miljarden jaren plaats vinden, sinds het ontstaan van onze wereld.
Inhoud van de module
1. Algemene begrippen
1.1 Hergroeperen van deeltjes
1.2 Reagentia, producten
1.3 De reactievergelijking
1.4 Reactieberekeningen
2. Chemische reacties en Energie
2.1 Reactie-energie; endotherm & exotherm
2.2 Activeringsenergie
2.3 Reactiestappen en de bijbehorende energieveranderingen
3. Reactiesnelheid
3.1 Reactiemechanisme / effectieve botsingen
3.2 Reactie-orde
3.3 Beïnvloeden van reacties
3.4 Diagrammen
4. Reactietypes
4.1 Vormingsreacties
4.2 Ontledingsreacties
4.3 Neerslagreacties
4.4 Exotherme en endotherme reacties
4.5 Overige reactietypes
5. Chemische Thermodynamica
5.1 Spontane en niet-spontane reacties
Bij een chemische reactie gaan geen deeltjes verloren en ook ontstaan niet spontaan nieuwe deeltjes; wat gebeurt is dat deeltjes van karakter veranderen en mogelijk van plaats en positie.
| De deelnemende deeltjes hergroeperen zich. |
Je kunt het ook anders benaderen: bij een chemische reactie zullen deeltjes zich van elkaar verwijderen en daarna elkaar weer benaderen, maar dan in andere samenstelling.
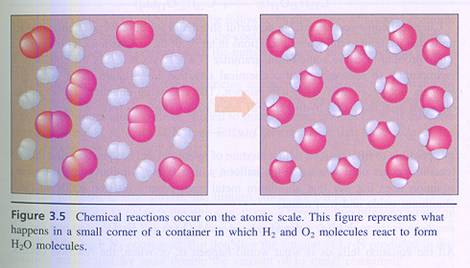
Opdracht 4
Bewering: "Bij een chemische reactie verandert het totaal aantal deeltjes niet."
Is die bewering waar of vals? Leg uit.
Opdracht 5
Beschrijf wat er gebeurt met de deelnemende deeltjes van de volgende reacties:
- fotosynthese (water + kooldioxide vormen glucose en zuurstof (gebruik zo mogelijk modellen of anders goeie schetsen)
- de neerslagvorming van zilverchloride (uitgaande van NaCl(aq) en AgNO3(aq))
Algemeen gezegd: reacties tussen deeltjes vinden alleen echt plaats op het moment dat die deeltjes met elkaar in contact komen. De deeltjes moeten botsen.
En dan nog: niet elke botsing leidt tot reactie; die botsing moet ook op de juiste manier plaats vinden, dus moet effectief zijn en met voldoende energie.
De betrokken deeltjes kunnen atomen zijn, ionen of moleculen en kunnen heel verschillend zijn in grootte.
Opdracht 6
Een macromolecuul kan reageren met een klein ion in de molverhouding 1:1.
Doe eens een schatting van de massaverhouding in dit geval.
Antwoord 07-06
Stoffen in een scheikundige reactie reageren of worden gevormd, altijd in een vaste verhouding.
Een reactie tussen reagentia gaat net zo lang door tot één van de stoffen op is.
De rest blijft dan gewoon over, kan niet meer reageren, was in 'overmaat' aanwezig. Het zal duidelijk zijn hoe raadzaam het is om van te voren goed te berekenen hoeveel van elke stof nodig is.
Alleen door goed berekenen kun je vermijden dat er stof zinloos overblijft, dat bovendien ook nog eens de reactie kan compliceren. Er kunnen soms niet bedoelde bijproducten gevormd worden.
Goed rekenen is dus een voorwaarde.
Een ander nadeel van slecht of niet rekenen (reactieberekeningen) is dat de producten aan het eind verontreinigd zullen zijn.
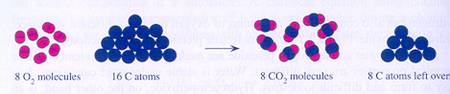
Opdracht 7
Veel reacties verlopen in aanwezigheid van stoffen die aan de echte reactie niet meedoen. Voorbeeld: neerslagreacties.
- Leg uit dat neerslagreacties verlopen in aanwezigheid van niet deelnemende stoffen.
- Bedenk meer voorbeelden van reacties die verlopen in aanwezigheid van niet deelnemende stoffen.
Bijproducten
In het laboratorium of in de chemische industrie wil men chemische producten maken.
Een algemeen probleem daarbij is dat, behalve het (de)bedoelde hoofdproduct(en), vrijwel altijd ook bijproducten ontstaan,
meestal onvermijdelijk, omdat de reactie nu eenmaal ook die stoffen oplevert.
Mogelijk levert dat geen probleem, maar vaak is een zuivering nodig die nogal gecompliceerd kan zijn. Een lastig probleem.
Opdracht 8
Bij de neerslagreactie:
NaCl(aq) + AgNO3(aq)  AgCl(s) + NaNO3(aq)
AgCl(s) + NaNO3(aq)
gaan de reagentia Ag+ + Cl- over in het product AgCl(s).
Behalve het bedoelde eindproduct vormt zich ook een bijproduct: NaNO3(aq). Dit is een eenvoudig voorbeeld van een bijproduct.
Hoe zou je in dit geval het eindproduct zuiver in handen kunnen krijgen?
De veranderingen bij een chemische reactie worden aangeduid met een pijl:  , de reagerende stoffen ervoor, de producten erna.
, de reagerende stoffen ervoor, de producten erna.
Reagentia  Producten
(reactievergelijking)
Producten
(reactievergelijking)
Je kunt soms de reactie in woorden opschrijven (zoals: calcium met water  kalk en waterstof)
kalk en waterstof)
Maar normaal gebruiken we de scheikundige symbolen voor elk deelnemend deeltje en is de molverhouding te zien (de reactie is kloppend) evenals de aggregatietoestand (de fase).
Het totaal aantal deelnemende elementaire deeltjes (atomen en ionen, maar ook protonen, neutronen en elektronen) verandert niet tijdens een reactie.
Je begint de vergelijking natuurlijk met de juiste formules, maar als die eenmaal staan, dan moet je er voor zorgen dat het aantal deeltjes per element aan beide kanten van de pijl gelijk is. Er verdwijnen namelijk geen atomen tijdens een normale scheikundige reactie, en er komen er ook niet zomaar bij.
Met "coëfficiënten" maken we de vergelijking kloppend: bijvoorbeeld, 2 moleculen van dit reageren met 3 ionen van dat enzovoort.
Die coëfficiënten geven: de MOLverhouding.
Daarnaast moet je ook altijd even kijken naar de elektrische lading aan beide kanten. Ook die mag niet veranderen. Als er toch verschillen zijn, dan moet dat in orde gemaakt worden.
Algemeen:
- Je zorgt voor de juiste formules van de deelnemende stoffen;
- Je maakt de vergelijking kloppend met de coëfficiënten;
- Je voegt de aggregatiestoestanden toe aan elke stof: (s) (l) (g) (aq); [(aq) is eigenlijk geen echte fase]
- Van ionen schrijf je normaal ook de ionenformules op in de vergelijking.
Alleen als er gerekend moet worden (reactieberekeningen), dan is het handig om de empirische formules te gebruiken, ook voor stoffen die uit ionen zijn opgebouwd.
Opdracht 9
Geef de vergelijkingen van de volgende reacties en geef de MOLverhouding van de reagentia.
- De fotosynthese
- Calcium reageert met water en vormt 'gebluste kalk' en een gas.
Geef hier twee reacties: één in ionen en één in empirische formules.
- De neerslagvorming bij het mengen van natriumhydroxide(aq) en koper(II)sulfaat(aq). (ook met ionenformules en met empirische formules)
- De vorming van amoniakgas uit de elementen
- De ontleding van water
- Krijt met zoutzuur
- De vorming van ijzer(II)sulfaat uit de elementen
- De verbranding van aardgas
- De verbranding van benzine
- De afgifte van twee elektronen door een atoom Calcium
Als het kan, beeld dan de reactie ook uit met atoommodellen.
Heel speciaal is de kernreactievergelijking. Daarin veranderen namelijk elementen, wat nooit gebeurt bij normale chemische reacties.
Toch gelden de normale regels van aantal deeltjes en de lading aan elke kant van de pijl net zo voor de kernreacties.
Voorbeelden:
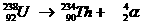
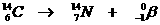
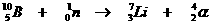
Opdracht 10
De regels voor gewone reactievergelijkingen gelden ook voor kernreactievergelijkingen.
Controleer dat.
Waar scheikunde wordt toegepast, bijvoorbeeld in een laboratorium of in de fabriek, bij het maken van een of ander product is het zeer belangrijk de nodige hoeveelheden te kennen:
Hoeveel product wil je? En hoeveel reagens is daarvoor nodig? In welke verhouding moeten we de stoffen mengen?
Goed rekenen voor je begint is niet alleen belangrijk om het juiste product te krijgen, maar getuigt ook van economisch inzicht. Het is dom om van iets teveel te gebruiken.
Opdracht 11
Iemand wil een duurzame zeepfabriek opzetten. Nodig voor het proces zijn: plantaardige olie, keukenzout, natriumhydroxide, water, energie, gebouwen, enzovoort.
Geef een kort overzicht van het directie-werkplan.
De toepassing van de reactieberekeningen kan alleen gedaan worden door iemand die met het begrip MOL weet om te gaan (zie ook module 5).
Zo is een belangrijke stap bij deze berekeningen het omrekenen van MOL naar grammen en omgekeerd. Daarnaast moet je weten wat dichtheid is van vaste en vloeibare stoffen.
Ken je de volgende vergelijking nog: d = g/v?
Gassen hebben ook een dichtheid, maar met een volkomen andere definitie dan de dichtheid van (s) en (l).
Alvast goed om iets te weten over gassen: wat voor gas je ook neemt, met grote of kleine moleculen, één mol ervan heeft altijd hetzelfde volume, gemeten bij dezelfde temperatuur en druk. Of andersom: als je 1 liter neemt van een willekeurig gas, gemeten bij een vaste temperatuur en druk, is dat bij elk gas een gelijk aantal mol.
Mol en volume zijn bij gassen dus evenredig. Dat gaat bij vaste en vloeibare stoffen niet op!
Voor gassen geldt: de coëfficiënten van gassen in een reactievergelijking kunnen zowel gelezen worden als mol én als liters.
Voor gassen: de MOLverhouding = de volumeverhouding.
Opdracht 12
Welk volume heeft 1 mol gas bij een druk van 1 atm. en een temperatuur van 0oC ?
Als methaan reageert met zuurstof in de verhouding 1:2 (één mol methaan reageert met 2 mol zuurstof), betekent dit tegelijk en automatisch dat, onder gelijke omstandigheden gemeten, 1 liter methaangas reageert met 2 liter zuurstofgas.
Wat je goed moet kennen zijn de begrippen "molariteit" en concentratie. Heel vaak komen we deze begrippen tegen bij reactieberekeningen.
Bijvoorbeeld: 10 ml 0,1M HCl reageert met een of andere stof. Je moet dan in staat zijn deze gegevens te begrijpen en te verwerken in de berekening. Je moet die schrijfwijze goed kennen.
Een reactieberekening begint altijd met een goed kloppende reactievergelijking die duidelijk de MOLverhouding aangeeft.
Opdracht 13
Calcium reageert met water waarbij calciumhydroxide en een gas ontstaan.
Welke MOLverhouding hebben de reagentia en bereken hun massaverhouding.
De berekening bij opdracht 13 is een voorbeeld om het voordeel te zien van het gebruik van empirische formules boven ionformules.
Berekenen gaat over praktische dingen en in de praktijk haal je geen ionen uit een fles, maar neutrale stoffen in hun geheel.
Dus ook al doet alleen een Chloride-ion mee, toch weeg je keukenzout af (NaCl).
Nogmaals: het is verstandig - voor een goed begrip van de praktijk - om aan te geven of de stoffen (s), (l) of (g) zijn (of (aq)).
Ca(s) + 2H2O (l)  Ca(OH)2(aq) + H2(g)
Ca(OH)2(aq) + H2(g)
De reagentia reageren in de MOLverhouding 1 : 2
Let op: die molverhouding geeft weer in welke verhouding de stoffen reageren; dat kan heel iets anders zijn dan de verhouding waarin je de stoffen in werkelijkheid mengt.
Als het niet in die juiste molverhouding is, blijft er gewoon ongebruikte stof over.
Opdracht 14
Een mengsel van 100 mol waterstof en 1 mol stikstof reageert niet in de verhouding 100:1, maar in de molverhouding gedefinieerd door de vergelijking.
Hoeveel mol product kunnen in dit geval maximaal gevormd worden?
|
Belangrijkste regels bij het oplossen van een reactieberekening: |
| 1 |
Een kloppende reactievergelijking opstellen en de aggregatietoestanden (de fasen) toevoegen. |
| 2 |
Onderstreep de stoffen waarover gegevens bestaan en waarover vragen gesteld worden. De andere stoffen hoef je niet mee te nemen in de berekening.
De gegevens worden soms direct, soms indirect gegeven.
De berekening doe je alleen met de onderstreepte stoffen. |
| 3 |
Noteer de MOLverhouding |
| 4 |
Waar nodig zet je MOL om in de juiste eenheden (die vind je bij gegevens en bij het gevraagde) |
| 5 |
Voer een omrekeningsfactor in om recht te doen aan de werkelijke hoeveelheden, zoals blijkt uit de gegevens.
Zo beëindig je de berekening. |
Let er op: het is absoluut nodig dat je in elke stap alle (onderstreepte) stoffen bij elke stap meeneemt, om te verzekeren dat je weet wat je aan het doen bent. Dan blijft het concreet.
Nog een mogelijkheid om de berekening concreet te houden is het schetsen van de gebeurtenis; maak een soort stripverhaal met bekerglazen, balansen, pipetten, met pijlen, enzovoort.
Opdracht 15
Hoeveel (massa en volume) kooldioxide worden gevormd bij de volledige verbranding van 4,01 g methaan?
antwoord 07-15
Nog eens de regels voor het oplossen van reactieberekeningen:
- Maak zo mogelijk een schetsje, een soort stripverhaal van de proef.
- Een kloppende reactievergelijking opstellen en de aggregatietoestanden toevoegen.
- Onderstreep de stoffen waarover gegevens bestaan en waarover vragen gesteld worden.
- Noteer de MOLVERHOUDING
- Zet zonodig MOL om in andere eenheden
- Voer de factor in om naar de werkelijke hoeveelheden te gaan (zoals gegeven).
Opdracht 16
1 gram Natrium wordt verbrand in 100 liter (afgesloten) lucht(0o C en 1 atm.).
Bereken, in grammen, hoeveel zuurstof overblijft.
Opdracht 17
Een ijzererts bevat 75% ijzer(III)oxide.
Bereken de massa van het ijzer dat verkregen kan worden uit 1 ton van dit erts.
Opdracht 18
Iemand gebruikt aardgas (methaan) om 5 liter water gedurende 15 minuten te koken, om eventuele bacteriën te doden.
Daarbij gebruikte ze 5 gram gas.
Bereken de massa, in grammen, van het benodigde zuurstof voor dit hele proces.
Opdracht 19
Om 1,3 mol aardgas te verbranden, hoeveel mol zuurstof zijn daarvoor nodig? (alles gemeten bij gelijke temperatuur en druk).
Opdracht 20
Bereken de hoeveelheid ammoniak en zuurstof (in grammen) die nodig zijn om 3,00 g NO te maken. Een bijproduct is water.
Opdracht 21
Geconcentreerd zwavelzuur bevat 96% puur H2SO4. De resterende 4% is water.
Bereken het aantal mol H2SO4 in één liter geconcentreerd zwavelzuur, als je weet dat de dichtheid daarvan 1,84 g/cm3 is.
Opdracht 22
3 mol chloor en 150 gram ijzer reageren met elkaar en vormen ijzer(III)chloride.
Welke stof is de beperkende stof (gaat helemaal op?): chloor of ijzer?
antwoord 07-22
Opdracht 23
Stikstof en Waterstof reageren in een directe reactie met elkaar en vormen het product ammoniak, in een industriële reactor met katalysator.
Er vormen zich 1000 gram product (ammoniak) met een rendement van 97,8%
De molecuulmassa van ammoniak = 17,0
Hoeveel mol reagens zijn nodig.
antwoord 07-23
Zoals eerder uitgelegd: bij een chemische reactie gaan deeltjes zich hergroeperen. Daarvoor zijn twee dingen nodig:
- eerst moeten er deeltjes los van elkaar
- daarna kunnen zo op een nieuwe manier weer aan elkaar gaan vastzitten
Algemene regel hierbij is dat losmaken van deeltjes energie kost en dat samevoegen van deeltjes energie oplevert.
Er zijn reacties die helemaal spontaan verlopen, niets nodig hebben, zoals bijvoorbeeld de natuurlijke radioactiviteit,
maar in de meeste gevallen heeft een reactie een actie nodig om op gang te komen.
Die actie kan van alles zijn: aansteken, verwarmen, licht, beweging, samenvoegen, elektriciteit, en andere.
Opdracht 24
Beschrijf de processen die plaats vinden als je een lucifer afstrijkt.
Elke stof heeft een zekere hoeveelheid (chemische) energie. De meest aangewezen plek voor deze chemische energie zijn de bindingen tussen de atomen van die stof. Daar kunnen dan ook de veranderingen plaats vinden.
Bindingen kunnen heel energierijk zijn, bijvoorbeeld de geactiveerde bindingen in ATP of ADP (dat zijn energiedragende moleculen in levende organismen).
Meestal zijn de bindingen normaal en vertegenwoordigen een hoeveelheid energie die we in tabellen kunnen opzoeken.
Als bindingen weinig energie bezitten, zullen ze meestal stabiel zijn.
In een chemische reactie veranderen de reagentia (die hun eigen hoeveelheid energie in hun bindingen hebben) in producten (die ook hun eigen, maar verschillende hoeveelheid energie hebben).
Dus:
Tijdens een chemische reactie treedt verandering op van chemische energie.
Er zijn drie mogelijkheden:
| I |
De producten hebben méér energie dan de reagentia |
In dit geval hebben de producten dus energie gewonnen, wat alleen kan als het systeem van buitenaf energie heeft verkregen (ΔH > 0). |
| II |
De producten hebben minder energie dan de reagentia |
Hier hebben de reagentia dus energie verloren; het systeem heeft energie afgestaan naar buiten (ΔH < 0). |
| III |
De producten hebben evenveel energie als de reagentia |
In dit geval is er sprake van een chemische evenwichtsreactie (ΔH = 0). |
Energiediagrammen
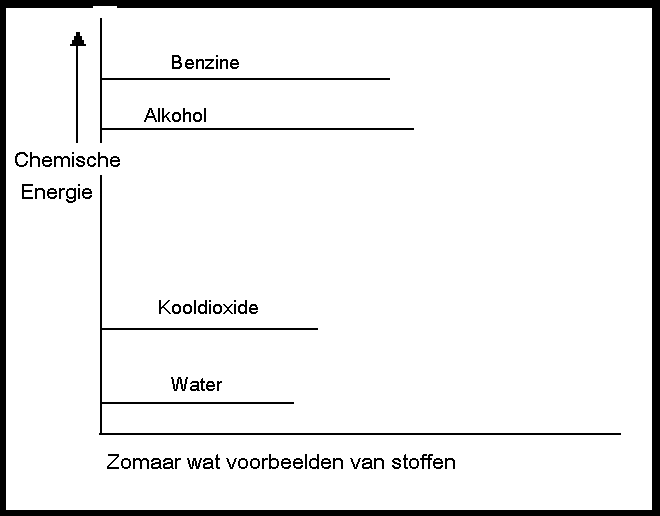
Als benzine reageert met zuurstof (dat zijn twee behoorlijk energierijke stoffen) vormen zich de producten water en koolzuurgas (twee stoffen met heel weinig interne energie).
Het systeem verliest dus een boel chemische energie tijdens deze verbranding. Die verdwijnt niet zomaar, want energie gaat niet verloren. Die komt naar buiten; in dit geval in de vorm van warmte.
Het verschil in energie van de producten en van de reagentia noemt men ook wel: de reactie-energie met een symbool: ∆H.
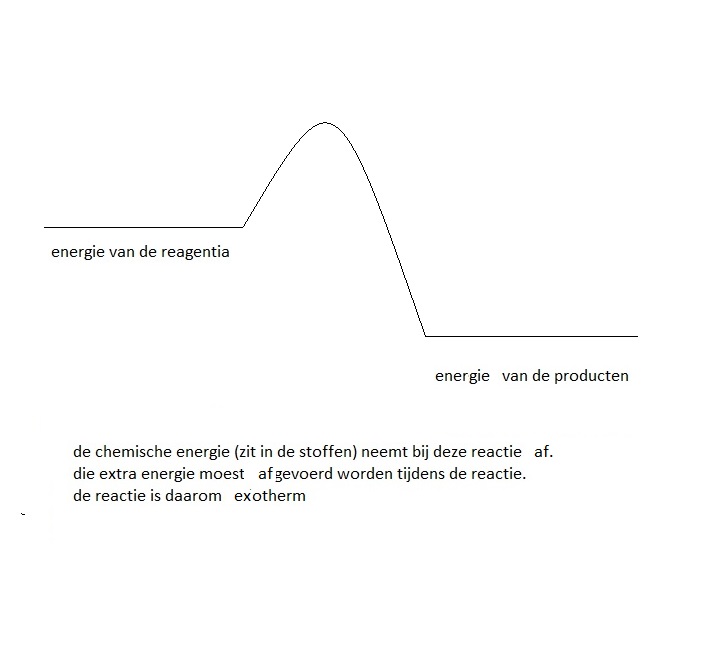
Als er energie wordt vrijgegeven door een systeem, krijgt ∆H een negatieve waarde. Het systeem verliest energie. We spreken van een 'exotherme' reactie. Het energieniveau van de producten ligt lager dan dat van de reagentia.
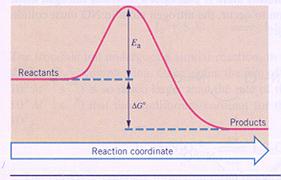
ΔGo geeft de reactie-energie aan waarvoor men vaak ook het symbool ΔH gebruikt.
Eais de activerings-energie.
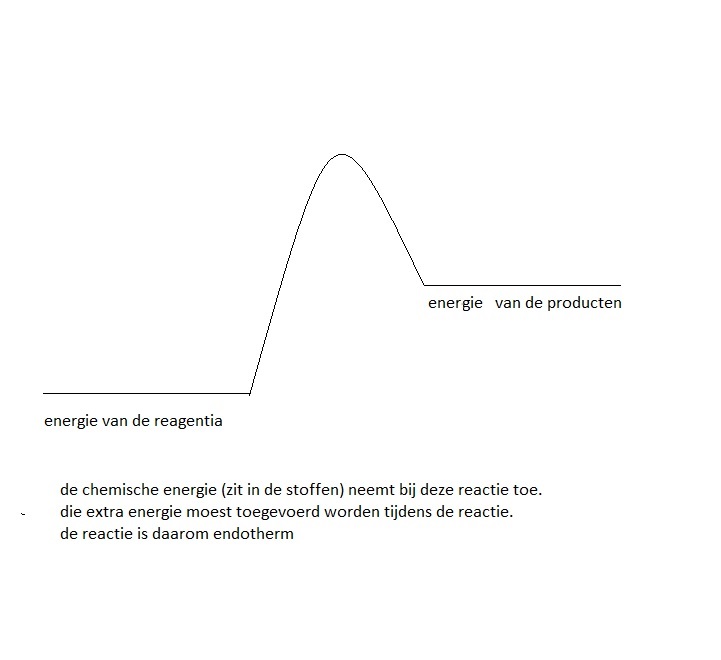
Als er energie wordt opgenomen door een systeem, krijgt ∆H een positieve waarde. Het systeem wint energie. We spreken van een 'endotherme' reactie.
Opdracht 25
Zal het condenseren van waterdamp een exotherm of een endotherm proces zijn? Leg je antwoord uit.
antwoord 07-25
Opdracht 26
Maak een energiediagram voor "de verbranding van benzine".
En zekere zin mag je zeggen: Er zijn "zwakke stoffen" (met weinig reactiviteit) en "sterke stoffen" (met veel reactiviteit).
Het merendeel van de scheikundige reacties heeft "hulp" nodig, d.w.z., een soort startmotor om op gang te komen.
Zelfs de reactie van benzine met zuurstof heeft een beetje 'activerings-energie' nodig: een vonkje of een lucifer of een elektrische ontsteker.
Andere reacties hebben soms juist erg veel activerings-energie nodig, zoals de vorming van ammoniak uit de elementen stikstof en waterstof.
Allerlei vormen van energie kunnen scheikundige reacties op gang helpen: licht, beweging, warmte, elektriciteit.

zonder katalysator
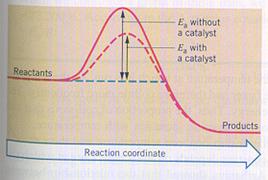
met katalysator
Een katalysator kan veel invloed hebben op de benodigde activerings-energie. Er zijn reacties die zonder katalysator helemaal niet lukken, niet van start gaan.
Explosieven
Explosieve stoffen hebben niet alleen zeer veel interne, chemische energie, maar ook starten ze heel gemakkelijk en vormen ze ook nog eens veel gasvormige producten.
De reagentia (de explosieven) waren vast of vloeibaar, dus er is tijdens de reactie - door de vorming van veel gassen - een enorme toename van volume in zeer korte tijd + het vrijkomen van heel veel energie.
TNT = trinitrotolueen vormt de producten: NO2, CO2 en H2O. Allemaal in gasvorm.
De ontploffing van slechts één miezerig grammetje TNT kan al in één klap enkele liters gasvorming veroorzaken.
Energie van de bindingen
Als atomen chemisch aan elkaar worden gekoppeld is er altijd sprake van vrijkomende energie. Het systeem verliest dan energie. De waarde van ΔH krijgt een negatief teken.
Dezelfde hoeveelheid energie is nodig om zo'n binding weer te verbreken, om die atomen weer van elkaar te verwijderen. Dan krijgt ΔH een positief teken.
We hebben tabellen met bindingsenergieën. Zo'n tabel mag je dus op twee manieren lezen:
- als bindingen gemaakt worden, atomen samenkomen, dan gebruik je het bedrag met een min-teken
- als bindingen verbroken worden, atomen gaan uit elkaar, dan gebruik je hetzelfde bedrag met een plus-teken.
Opdracht 27
De bindingsenergie van het stikstofmolecuul is zeer hoog. Leg uit waarom.
antwoord 07-27
Elke stap van een reactie komt met energieveranderingen, want elke stap verandert iets aan de deeltjes en/of de bindingen.
Vuistregel:
Bindingen verbreken, deeltjes uit elkaar halen, kost energie, is endotherm.
Bindingen maken, deeltjes samenvoegen, levert energie op, is exotherm.
of
Verwijderen kost energie en samengaan levert energie op.
[Wil je dus energie besparen, blijf dan vooral bij elkaar!]
De fundamentele stappen in een scheikundige reactie zijn: verbreken van bindingen en weer nieuwe bindingen vormen.
Om goed te begrijpen wat er bij een chemisch proces gebeurt, moet je proberen je voor te stellen wat de deeltjes doen.
Bijvoorbeeld:
Als je twee gassen, ammoniak en waterstofchloride, mengt, dan vormt zich een witte rook van de vaste stof ammoniumchloride (een zout).
Diverse reactiestappen vormen de totaalreactie:
NH3(g) + HCl(g)  NH4Cl(s)
NH4Cl(s)
Een voordeel hier is dat de reagentia al gasvormig zijn, dus, het is hier niet nodig die gasdeeltjes eerst uit elkaar te halen. (Meestal, bij vaste stoffen en vloeistoffen dus, is dat wel zo en dat alleen al kost alweer energie).
Van elk HCl-molecuul moet eerst een H—Cl binding worden verbroken, een endotherm proces, kost energie.
Direct daarop kunnen de nieuwe bindingen N—H (resultaat: NH4+) gemaakt worden en dat levert dan weer energie op, is een exotherm proces.
De tabel met bindingsenergieën laat zien in tabel VI:
1 mol H—Cl bindingen verbreken kost 432 kJ
1 mol N—H bindingen maken levert op 391 kJ
Als je dus alleen met deze gegevens rekening houdt, mag je de conclusie trekken: de totaalreactie is endotherm (het kost meer dan het oplevert).
Maar we zijn nog niet klaar:
Er vormen zich ionen (1 mol ionen NH4+ en 1 mol ionen Cl-).
En die ionen trekken elkaar aan, ze gaan bij elkaar zitten in een ionrooster, en dat samengaan levert ook flink wat energie op:
Het vormen van 1 mol ionrooster NH4Cl(s) levert 400 kJ op.
Het totale proces wordt dan toch nog flink exotherm met een reactie-energie van 391 + 400 - 432 kJ = 359 kJ per mol gevormd ammoniumchloride.
Opdracht 28
Als de elementen Natrium en Chloor met elkaar reageren, verloopt er een chemische reactie die keukenzout produceert.
Op basis van een goed kloppend gemaakte reactievergelijking, en met behulp van de energietabel (tabel VI) moet je berekenen hoeveel energie er vrijkomt of nodig is bij de vorming van één mol keukenzout uit de elementen.
Andere gegevens zijn:
- De atomen van Natrium bevinden zich in een metaalrooster.
- Daarna vormen zich Natrium-ionen door elektronenverlies.
- De diatomische moleculen van Chloor moeten eerst uit elkaar en
- daarna pikt elk atoom een elektron om een ion te vormen.
- Tenslotte gaan alle nieuwe ionen in een ionrooster zitten.
Opdracht 29
De vorming van water uit zijn elementen is een sterk exotherm proces (explosie).
Het product, aanvankelijk in gasvorm (damp) wordt vloeibaar bij afkoeling.
H2(g) + ½O2(g)  H2O(l) ∆H < 0
H2O(l) ∆H < 0
Geef alle stappen van dit proces tot aan het vloeibare water; elke stap met zijn energie. En bereken zo ook de totale reactie-energie.
In het algemeen, maar zeker in de koolstofchemie, mogen de reactiestappen onderverdeeld worden in:
- de start, of initiatie van de reactie
- de hoofdreactie, de vorming van het product
- slotreacties of terminatie
Stappen 2 en 3 kunnen bijproducten opleveren.
Elke scheikundige reactie verloopt met een bepaalde reactiesnelheid V die je als volgt kan definiëren:
V = de hoeveelheid reagens die per seconde verdwijnt,
of:
de hoeveelheid product die per seconde wordt gemaakt.
Waarom de ene reactie zo snel verloopt en een andere juist erg langzaam, dat heeft te maken met een aantal factoren die deze snelheid beïnvloeden.
Elke reactie heeft een reactiemechanisme: De opeenvolging van verschillende reactiestappen.
Bij de stappen vormen zich tussenproducten. Als er meerdere stappen zijn, hangt de totaalsnelheid af van de langzaamste stap.
Opdracht 30
Leg uit waarom de langzaamste stap de totaalsnelheid bepaalt.
Er bestaan chemische reacties waarbij de deeltjes (moleculen bijvoorbeeld) - eenvoudigweg omdat ze voldoende energie bezitten - uit elkaar vallen, ontleden in een ontledingsreactie.
In dat geval hangt de reactiesnelheid niet af van de aanwezigheid van andere deeltjes.
Dat zijn reacties van de eerste orde (unimoleculair) wat wil zeggen: de deeltjes hoeven niet te botsen met andere deeltjes om tot reactie te komen. Ze kunnen zich spontaan delen in verschillende onderdelen.
Opdracht 31
De ontleding van Ozon wordt een 'unimoleculaire' reactie genoemd of ook een reactie 'van de eerste orde'.
Leg deze uitspraak uit.
Opdracht 32
Analyseer de volgende grafiek van de ontleding van 14C in een eerste-orde-reactie (unimoleculair).
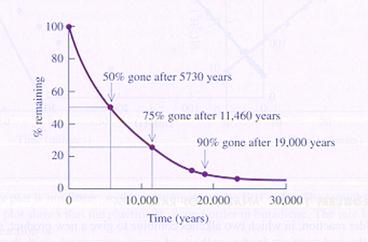
Een ander voorbeeld van een unimoleculaire reactie is de ontleding van N2O4.
Met voldoende energie zal het molecuul zich verdelen in twee delen (NO2).
Verder is dit een zeer elementaire reactie: bestaat uit slechts één stap.
Opdracht 33
Leg uit dat bovenstaande ontledingsreactie het omgekeerde is van de reactie in de navolgende figuur:
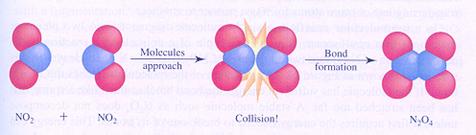
effectieve botsing
De meeste scheikundige reacties zijn niet unimoleculair, maar bimoleculair: twee deeltjes moeten botsen en een effectieve botsing leidt dan tot een reactie.
Dat zijn geen elementaire reacties, ze hebben een gecompliceerd reactiemechanisme met diverse stappen.
Een bimoleculaire reactie verloopt niet automatisch succesvol bij elke botsing. De botsing moet 'effectief' zijn.
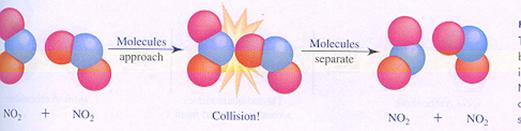
een niet effectieve botsing
Hieronder zie je in de afbeeldingen twee mogelijke (verschillende) mechanismen van de reactie tussen moleculen van stikstofdioxide. Je ziet verschillende stappen.
In geval I botsen twee moleculen en zo start de reactie.
In geval II splitst één molecuul en één van de producten botst met een ander molecuul.
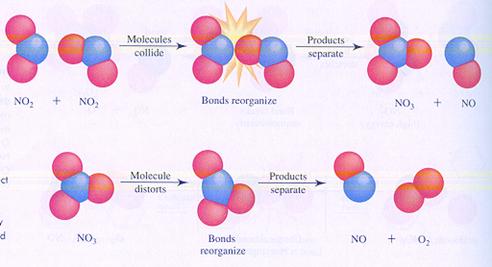
geval I
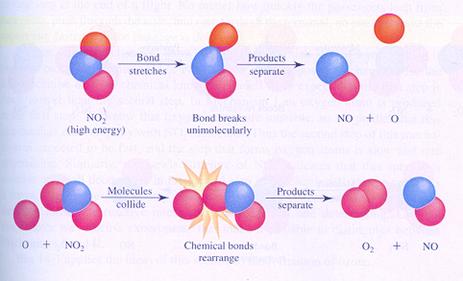
geval II
Opdracht 34
Vergelijk de twee mechanismen en zoek de verschillen.
antwoord 07-34
De reactiesnelheid kun je beïnvloeden met verschillende factoren.
Voor de reactiesnelheid is een formule afgeleid waarin de belangrijkste en invloedrijkste factoren zijn opgenomen.
De snelheid hangt af van de concentratie van de reagentia [ ], van de verdeling / het oppervlak van de stof (homogeen of heterogeen),
van de temperatuur (oC of K), en van de eventuele aanwezigheid van een katalysator.
V ≈ [concentratie] x verdeling x energie van de deeltjes x katalysator.
Zo is deze formule tamelijk onbruikbaar. Het is een formule in woorden. We willen graag getallen.
Je kunt hem vereenvoudigen door sommige omstandigheden constant te houden en zo alleen de (variabele) concentraties te behouden.
We krijgen dan een wiskundige formule:
V = k.[conc.]n
- V: is de snelheid;
- k: vertegenwoordigt het geheel van constant gehouden overige factoren;
- n: is de coëfficiënt van het reagens in de reactievergelijking;
- Op deze wijze verschijnen de concentraties van elke homogene stof in de formule. Heterogene stoffen laat je weg.
- Een reactie waarbij k een hoge waarde heeft, heeft 'sterke reagentia'
- Een reactie waarbij k een lage waarde heeft, heeft 'zwakke reagentia'
Opdracht 35
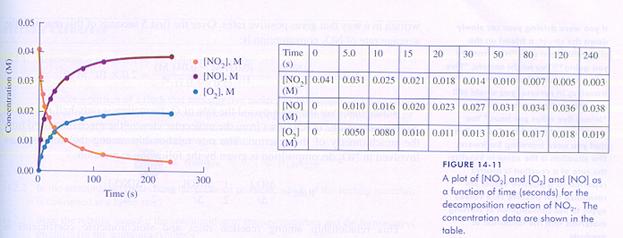
Controleer de overeenkomst tussen de gegevens in onderstaande tabel en grafiek.
Als je goed naar de drie grafieken kijkt, wat is dan je commentaar?
Opdracht 36
Waarom is het niet mogelijk om de concentratie van reagentia constant te houden gedurende een reactie?
antwoord 07-36
Opdracht 37
Geef de formule van de reactiesnelheid van:
H2(g)+ Br2(g)  2HBr(g)
2HBr(g)
Belangrijk bij reactiesnelheden is de reactiviteit van deeltjes. Er zijn deeltjes met een zeer hoge reactiviteit, die men wel "radikalen" noemt.
Radikalen vormen zich - algemeen gesproken - onder invloed van licht en hebben als eigenaardigheid dat ze één of meer ongepaarde valentie-elektronen bezitten.
Radikalen zijn neutraal.
Voorbeelden: Cl· Br· — C — C — O·
Opdracht 38
Leg uit waarom Ozon (O3) gemakkelijk radikalen vormt.
Andere aanvallende deeltjes zijn die met ladingen. Sommige geladen deeltjes vertonen ook een grote reactiviteit, zoals (+, -, δ+ ou δ-).
We onderscheiden hierbij twee mogelijkheden:
- een negatief deeltje valt aan op een positief deeltje = nucleofyl mechanisme
- een positief deeltje valt aan op een negatief deeltje = elektrofyl mechanisme
Een geschikt voorbeeld om uit te zoeken is de organische reactie tussen alkanolen en alkaanzuren in aanwezigheid van de katalysator zwavelzuur
propaanzuur + ethanol  ethylpropanaat + water
ethylpropanaat + water
(zwavelzuur = katalysator)
De reactie-orde definieert men als de som van de exponenten van de concentraties in de formule voor de snelheid V.
Normaal wordt deze exponent afgeleid van de coëfficiënten in de reactievergelijking.
Opdracht 39
Wat zal de orde zijn van de onderstaande reacties?
| Cl2 |
 |
2 Cl· |
V = k*[Cl2] |
2NO2 |
 |
N2O4 |
V = k*[NO2]2 |
| CH3I + OH- |
 |
CH3OH + I- |
V = k*[CH3I]*[[OH-] |
|
|
|
|
Even terug naar de reactie: H2(g)+ Br2(g)  2HBr(g)
2HBr(g)
Dit lijkt een reactie van de tweede orde (bimoleculair), maar metingen van de snelheid tonen aan dat de orde van deze reactie = 1½.
Hoe leggen we dit uit?
De reactiestappen (met radikaal-mechanisme):
- Br2
 2Br·
2Br·
dit evenwicht wordt gemakkelijke en snel bereikt
- Br· + H2
 HBr + H·
HBr + H·
dit is de langzame stap
- H· + Br2
 HBr + Br·
HBr + Br·
dit is de snelste stap
Opdracht 40
Geef de eerste stap, de laatste stap en de hoofdstap van bovenstaande reactie.
Stap 2, de traagste, is bepalend voor de totaalsnelheid:
| Vtotal = |
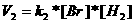 |
| Evenwicht 1 heeft als voorwaarde: |
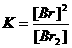 |
Als we de twee (wiskundige) vergelijkingen combineren, kunnen we berekenen:
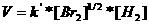
Dit betekent dat de reactie-orde gelijk moet zijn aan 1½ (zie exponent)
Als de reactiesnelheid afhankelijk is van het aantal effectieve botsingen, is de volgende vraag:
- Hoe kun je het aantal botsingen beïnvloeden?
- Hoe kun je de effectiviteit van die botsingen beïnvloeden?
Factoren die het aantal botsingen beïnvloeden:
- Het aantal aanwezige deeltjes is evenredig met de concentratie of (bij gassen) met de druk. Hoe meer deeltjes, hoe meer kans op botsing.
Let op: tijdens een reactie neemt het aantal reagerende deeltjes automatisch af en dus ook het aantal botsingen en dus wordt de reactiesnelheid lager met de tijd.
- Het karakter en de situatie van de reagerende deeltjes.
Hoe bevinden ze zich in de reactie? Zijn ze fijn verdeeld? Hebben ze groot oppervlak? Veel of weinig energie? Groot of klein? Zijn ze goed gemengd? Enz.
- De temperatuur van de reagentia. Die heeft meteen invloed op de beweging: hogere temperatuur, meer beweging, dus meer kans op botsing.
OBS. Van concentratie spreken we alleen als de verdeling van de deeltjes homogeen is. In geval van heterogene stoffen spreken we niet van concentratie.
In de formules voor V wordt voor deze heterogene stoffen eenvoudigweg 1 ingevuld.
Factoren die de effectiviteit van botsingen beïnvloeden
- De aanwezigheid van een katalysator. Die maakt dat de botsing tussen de deeltjes minder willekeurig is, minder toevallig; een katalysator begeleidt, richt, begeleidt de botsingen.
De deeltjes botsen precies op de juiste plek, bijvoorbeeld, dank zij een katalysator, die zo grote invloed heeft. (zie ook bio-katalyse)
- Nog eens de temperatuur. Niet alleen wordt de snelheid groter van de deeltjes, maar ook hun energie. En dat kan een hogere effectiviteit opleveren.
N.B. Elke chemische reactie heeft een minimumenergie nodig om te starten. Je kunt zo reacties bevriezen.
Zo snel mogelijk (in één klap) de temperatuur verlagen tot onder het minimum; dan valt de snelheid in één keer terug naar 0 mol/sec.
Opdracht 41
Bij de ammoniaksynthese volgens Haber Bosch, zal de katalysator die stap vergemakkelijken die N2-moleculen verdeelt in twee atomen N.
Daarna reageert een N-atoom met H2, etc.
- Geef minstens twee stappen van deze reactie en geef ook de orde van elke stap.
- Wat zal de langzaamste stap zijn en waarom?
Blussen
Opdracht 42
Welke methode heb je wel eens toegepast om vuur te doven bij brand?
Er zijn nogal wat manieren om een brand te blussen:
- afkoelen totdat de temperatuur onder de minimum-reactietemperatuur komt.
- Verwijderen van reagentia
- De aanvoer van reagentia onmogelijk maken, afsluiten
- Een hulpstof toevoegen die zelf onbrandbaar is
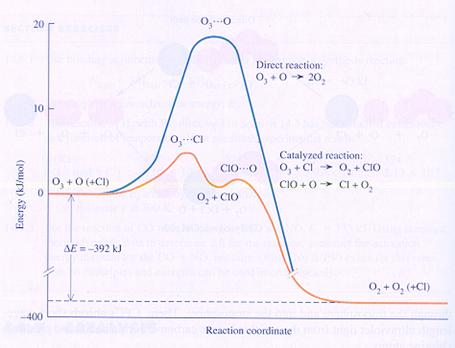
(Bio)katalyse
In het bovenstaande diagram zie je de chemische energie op de verticale as en het verloop van de reactie op de horizontale as:
Ozon + zuurstofatomen vormen normaal zuurstof, met behulp van chlooratomen (katalysator).
Zonder chloor moet er een tussenproduct worden gemaakt met zeer veel energie (O3---O), dus waarvan de vorming erg veel energie kost.
Het chlooratoom kan een anderssoortig tussenproduct maken dat minder energie kost.
Temperatuur
In het algemeen mag je zeggen dat temperatuursverhoging versnelling van de reactie meebrengt. Een vuistregel is
Elke 10 graden verhoging verdubbelt ongeveer de reactiesnelheid.
Temperatuurverhoging betekent automatisch: meer beweging van de aanwezige deeltjes;
dat betekent méér botsingen tussen de reagerende deeltjes met méér energie.
Opdracht 43
Maak twee grafieken in één diagram:
- De reactiesnelheid bij een bepaalde temperatuur (bijv. 25oC) versus de reactietijd in minuten.
- De snelheid van dezelfde reactie bij een 2x zo hoge temperatuur (50oC).
Concentratie veranderen; toevoegen en weghalen van stoffen
Het volgende diagram vertoont de concentraties van de reagentia en producten van een proces dat bezig evenwicht te bereiken:
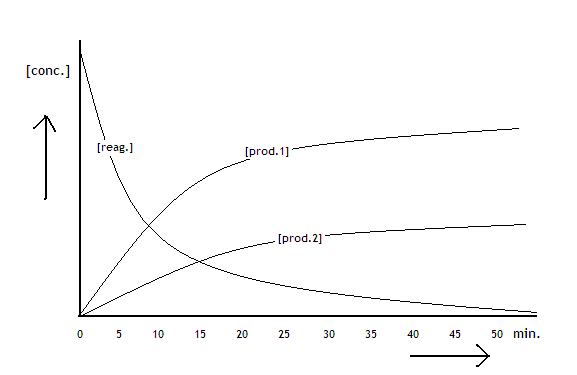
Opdracht 44
Op tijdstip 20 (minuten) voegt men 1 mol extra reagens toe. Hoe gaat de grafiek er nu uitzien?
Opdracht 45
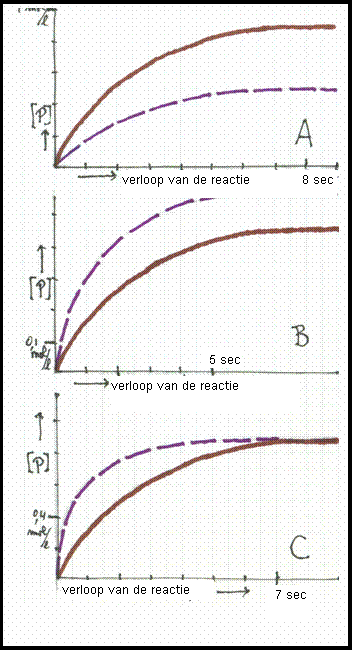
De drie diagrammen tonen grafieken: concentratie van het product in mol/l versus verloop van de reactie in seconden.
Twee grafieken verschillen alleen in temperatuur, op zo'n manier dat de ononderbroken lijn de situatie laat zien bij de laagste temperatuur.
Kies het juiste diagram en leg je antwoord uit.
antwoord 07-45
De reactiesnelheid hangt altijd af van de concentratie van de homogene stoffen. Het heeft meteen gevolgen als je de concentratie van een reagens verandert.
Bij het toevoegen van een van de reagentia zal meteen de snelheid hoger worden (voor enige tijd).
Terwijl alle scheikundige reacties vele kenmerken gemeenschappelijk hebben, kunnen we toch diverse types onderscheiden.
Er kunnen bindingen verbroken of gevormd worden, geheel of gedeeltelijk; er kunnen elektronen of ander deeltjes worden overgedragen van een stof naar een andere; er kunnen zich producten vormen van een bepaald soort; reacties kunnen al dan niet in evenwicht zijn, endo- of exotherm, enzovoort.
Het is niet het meest boeiende deel van de scheikunde misschien, maar je moet echt een beetje in staat zijn om de scheikundige reacties in te delen.
Over reactietypes vind je ook informatie op wikipedia. Je zult zien dat de scheikundige reacties op verschillende manier kunnen worden getypeerd en ingedeeld.
Het kan bijvoorbeeld op basis van:
- De ontdekker van de reactie: Diels-Alder-reactie, Grignard-reactie, Andrussow-proces, Bunsen-reactie
- De karakteristieke experimentele omstandigheden: katalytische hydrogenering, pyrolyse, thermolyse
- De transformatie in brede zin (vooral in de organische chemie): additie, eliminatie, substitutie, omlegging
- De specifieke transformatie: zuur-basereactie, redoxreactie, alkylering, transesterificatie, ringsluiting
- Het type mechanisme: ionair, radicalair, pericyclisch, gekatalyseerd door een overgangsmetaal of complex
Ook bij wikipedia wordt op een veel algemener niveau onderscheid gemaakt tussen reacties die een nieuwe verbinding maken, synthesereacties of combinatiereacties en reacties waarbij een verbinding wordt afgebroken, ontledingsreacties.
Net als hierboven vind je daar de opmerking dat elke reactie de reactanten afbreekt en reactieproducten vormt; elke reactie moet dus zowel als ontleding en als synthese kunnen worden beschreven. Daarom wordt vaak een iets duidelijkere definitie gebruikt: bij een ontledingsreactie is maar één reactant betrokken, en bij een synthesereactie wordt maar één product gevormd.
zie wikipedia
Bij vormingsreacties wordt een stof gevormd uit zijn elementen. Meestal zijn vormingsreacties exotherm.
Vormingsreacties zijn als zodanig onder te verdelen in stappen.
Een voorbeeld:
De vorming van water uit de elementen waterstof en zuurstof vereist de volgende eerste stappen:
- H2
 2H
2H
- O2
 2O
2O
- Pas als twee losse waterstofatomen en een los zuurstofatoom vrij bestaan, kunnen ze een molecuul water vormen.
- 2H + O
 H2O
H2O
- Over het algemeen, maar niet altijd(!) zullen de exotherme stappen overheersten bij vorming van stoffen uit de elementen.
Met behulp van de tabel met bindingsenergieën, kun je het energie-effect berekenen van de vorming van water:
- H2 + ½O2
 H2O
H2O
- 1 mol H-H bindingen worden verbroken (kost hoeveel energie?); teken +
- 1 mol O=O bindingen wordt verbroken (kost hoeveel energie?); teken +
- Er vormen zich 2 mol O-H bindingen (energie komt vrij, hoeveel?); teken -
Opdracht 46
Bereken op dezelfde manier het energie-effect van de vorming van één mol HCl uit de elementen.
Dat zijn reacties waarbij een stof ontleed wordt in de elementen. Over het algemeen zijn deze reacties endotherm.
De energie die nodig is voor de ontleding van een verbinding, is omgekeerd aan de energie die vrijkomt bij de vorming van de stof uit de elementen. We mogen dus dezelfde tabel gebruiken voor ontleding en vorming; vergeet alleen niet het teken te veranderen.
tabel met bindingsenergieën
Opdracht 47
- Elke chemische reactie kunnen we onderverdelen in verbindings- en ontledingsreacties. Leg dat uit.
- Er is een andere manier om alle reacties in twee soorten te verdelen. Welke is dat?
antwoord 07-47
Dan gaat het over reacties in waterig milieu waar zich ionen bevinden die tezamen een onoplosbaar ionrooster vormen.
Voeg je twee ionaire (opgeloste) stoffen samen (meestal komen er dan vier verschillende ionen bij elkaar, twee positieve en twee negatieve), dan kan het gebeuren dat er een nieuwe combinatie bij zit die onoplosbaar is. Of een combinatie van ionen al dan niet oplosbaar is, kun je vinden in
tabel XI
De andere (niet reagerende) ionen blijven gewoon vrij in de oplossing zitten, ondergaan dus geen reactie.
Een enkele keer gebeurt het dat er twee nieuwe onoplosbare combinaties gevormd worden.
Een gevormd neerslag kun je uit de oplossing halen door bijvoorbeeld 'decanteren', filtreren of centrifugeren.
Een samenvatting:
Exotherm is de reactie waarin de producten minder (chemische of interne) energie bezitten dan de reagentia.
Endotherm is de reactie waarin de reagentia minder energie bezitten dan de producten.
Deze paragraaf dient alleen om nog een aantal andere reactietypes te noemen; meer niet.
In andere modules zullen we dieper op die reacties in gaan.
Zuur-base-reacties
Reacties waarbij H+-overdracht plaats vindt van het zuur (donor) naar de base (receptor)
zie ook module 09
Redoxreacties
Reacties met elektronenoverdracht: één of meer elektronen gaan van de reductor (donor) naar de oxidator (receptor)
Als de oxidator zuurstof is, dan spreekt men wel van verbranding, die direct of indirect kan verlopen.
zie ook module 10
Hydrolyse en Condensatie
Aan deze reacties doet water mee. Dat water wordt verbruikt bij hydrolyse en komt vrij bij condensatie.
Splitsen van een molecuul in twee delen waarbij water gebruikt wordt = Hydrolyse
Samenvoegen van twee moleculen waarbij één nieuw molecuul wordt gevormd en waarbij water vrijkomt = Condensatie
Hydrolyse en Condensatie zijn elkaars tegengestelde.
zie ook module 11
Er is ook poly-hydrolyse en poly-condensatie, bij voorbeeld bij de productie of het afbreken van proteïnen of van zetmeel.
polyethers of polyesters kunnen ook hydrolyse ondergaan.
Additie en Eliminatie
Ook additie en eleminatie zijn elkaars tegengestelde reacties.
Als twee moleculen zich verenigen door het openbreken van een onverzadigde binding, heb je additie.
Bij eliminatie ontstaan twee nieuwe moleculen uit één, waarbij één van die nieuwe onverzadigd wordt.
Bij poly-additie vormen zich macromoleculen; uitgangsstoffen zijn dan altijd onverzadigde moleculen.
Polymerisatie
Bepaalde moleculen, van één of meerdere types koppelen zich aan elkaar in grote hoeveelheden, waarbij macromoleculen of ook (co)polymeren worden gevormd. poly-additie is dus een vorm van polymerisatie.
Er is nog een aspect van de scheikunde dat bij reacties om de hoek komt kijken: een tamelijk natuurkundig concept dat de energie van scheikundige veranderingen op een andere manier omschrijft, een niet-moleculaire, macroscopische manier. Je kijkt er dan niet naar op deeltjesniveau.
We behandelen deze theorie hier op een globale en beperkte manier en beperken ons tot de belangrijkste begrippen, waarbij het natuurkundige begrip 'arbeid' maar heel kort aan bod komt.
De volgende begrippen moet je ongeveer kennen: energie (chemische, kinetische, elektrische, potentiële en stralingsenergie); activeringsenergie, endo- en exotherm, bindingsenergie.
De hoofdwet van de thermodynamica is: energie gaat niet verloren en komt geen energie uit het niets tevoorschijn.
Eigenlijk net zoiets als: de wet van behoud van massa.
We kennen de eerste hoofdwet als de Wet van Hess, al heel lang geleden - lang voor de thermodynamica - geformuleerd.
Energieverlies of -winst door stoffen tijdens een chemische reactie hangt alleen af van de energienivo's van de reagentia en de producten, niet van de weg die tijdens de reactie wordt afgelegd.
Maar natuurlijk kan de ene vorm van energie wel overgaan in een andere vorm en dat geldt ook voor het natuurkundige begrip "arbeid".
Deze "arbeid" (p x ΔV) wordt dan beschouwd als energie die zich manifesteert. Je ziet het er aan af, zeg maar.
De energie zonder de "arbeid" krijgt het symbool: U.
De energie met die arbeid krijgt het symbool H (ook wel enthalpy genoemd, maar dit woord laten we in deze cursus buiten beschouwing).
Dus: U is de som van H en "arbeid".
Tijdens een chemisch proces zijn er omzettingen van energie: ΔH en ΔU. U en H veranderen.
ΔU is de reactie-energie (met negatief teken als het systeem energie verliest en positief teken als het systeem energie wint).
En hier duikt nu een nieuwe vorm van energie op, die we ENTROPIE noemen en het symbool S heeft.
S is niet een positieve vorm van energie, zoals warmte of elektriciteit, waar je wat mee kunt doen. Nee, de entropie is eigenlijk een negatief soort energie, een verloren energie, energie waar je niets aan hebt.
S wordt gekoppeld aan de wanorde die in een systeem heerst: hoe netter geordend een systeem, des te minder entropie (in kristallen bijvoorbeeld).
Zodra je zo'n kristal oplost in water gaat die keurige orde verloren, alle ionen van het kristal gaan rondzwemmen, de wanorde neemt toe in het systeem, ofwel: de entropie S neemt toe:
Dit gaat helemaal ten koste van de nuttige vormen van energie en die S kun je niet negeren. De entropie moet op een of andere manier in het totale energieplaatje worden opgenomen.
Zodoende kwam men tot het definiëren van nog een begrip: de energie die alle mogelijke vormen van energie omvat:
| de vrije energie, met het symbool G |
G bevat dus zowel H als S.
Een chemisch systeem in verandering (dus meestal een reactie) ondergaat verandering in G: ΔG
en deze verandering betekent ook verandering in H en verandering in S.
De wiskundige formule die deze veranderingen weergeeft is als volgt:
ΔG = ΔH - TΔS
ΔS krijgt een negatief teken omdat het een vorm vertegenwoordigt van negatieve energie.
Entropie heeft direct verband met de temperatuur wat je kunt zien aan de T (in Kelvin) in de formule. Je kunt je misschien voorstellen dat deeltjes bij hogere temperatuur veel heftiger gaan bewegen, en dat daarmee de wanorde toeneemt.
Je kunt het proces "keukenzout lost op in water" beschouwen als een systeem in verandering.
Eerst heb je zout(s) en water(l) en daarna verschijnt een zoutoplossing:
NaCl(s)  NaCl(aq) ΔH > 0
NaCl(aq) ΔH > 0
Het is niet echt een chemische reactie, maar er gebeurt wel iets met de deeltjes:
- Het ionrooster wordt verbroken
- De ionen worden gehydrateerd (omgeven door watermoleculen)
- Het totaalproces is endotherm, (kost energie) en toch is het totaalproces spontaan. De reden hiervoor is de enorme toename van de entropie gedurende dit proces.
Opdracht 48
- Is stap 1 endotherm of exotherm? Leg je antwoord uit.
- Is stap 2 endotherm of exotherm? Leg je antwoord uit.
- Leg ook uit dat dankzij de entropietoename het totaalproces spontaan verloopt.
Het al dan niet spontaan verlopen van een chemische reactie heeft alles te maken met thermodynamische gegevens.
Er is een zgn. tweede hoofdwet van de thermodynamica die zegt:
Processen zijn spontaan als er toename is van Entropie
Je kunt ook zeggen: als de mate van wanorde toeneemt bij een systeem dan kan het proces spontaan zijn, zelfs als heb je een endotherm proces.
Als ionen in een ionrooster zich van elkaar verwijderen en vrij kunnen gaan bewegen door de oplossing, dan neemt de mate van wanorde flink toe en dus de entropie S.
Oplossen van zout in water is dan ook duidelijk een spontaan proces, ook al kost het losmaken van de ionen flink wat energie.
Neem een explosie: een vaste stof, met veel orde (weinig entropie) verandert helemaal in gassen (veel wanorde, veel entropie); Explosie is zeer spontaan.





 AgCl(s) + NaNO3(aq)
AgCl(s) + NaNO3(aq)
 , de reagerende stoffen ervoor, de producten erna.
, de reagerende stoffen ervoor, de producten erna.
 Producten
(reactievergelijking)
Producten
(reactievergelijking)
 kalk en waterstof)
kalk en waterstof)
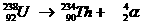
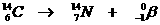
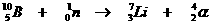
 Ca(OH)2(aq) + H2(g)
Ca(OH)2(aq) + H2(g)




 NH4Cl(s)
NH4Cl(s)
 H2O(l) ∆H < 0
H2O(l) ∆H < 0






 2HBr(g)
2HBr(g)
 ethylpropanaat + water
ethylpropanaat + water



 2HBr(g)
2HBr(g)
 2Br·
2Br·
 HBr + H·
HBr + H·
 HBr + Br·
HBr + Br·
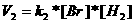
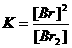
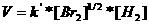



 2H
2H
 2O
2O
 H2O
H2O
 H2O
H2O


 NaCl(aq) ΔH > 0
NaCl(aq) ΔH > 0