1. Korte geschiedenis van het atoombegrip
2.2 Radioactiviteit & straling
6. Relatie tussen atoomstructuur en licht
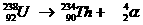
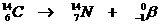
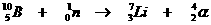
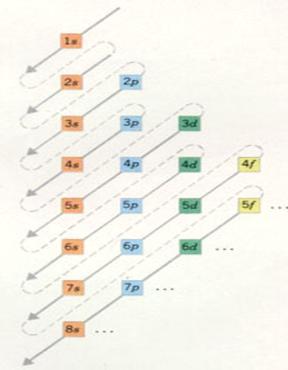
| Hoofschil 1 bestaat uit slechts één subnivo, |
van het type s | met een maximaal aantal elektronen van: |
2 |
| Hoofdschil 2 heeft 2 onderschillen, subnivo's |
van het type s e p | met een maximaal aantal elektronen van: |
2 en 6 |
| Hoofschil 3 heeft 3 subnivo's |
van het type s p d | met een maximaal aantal elektronen van: |
2, 6 en 10 |
| Hoofdschil 4 heeft 4 subnivo's |
van het type s p d f | met een maximaal aantal elektronen van: |
2, 6 , 10 en 14 |
De hoofdschillen 5 tot 7 zouden zich - theoretisch -
kunnen onderverdelen in 5, 6 en 7 subnivo's. Maar zulke grote atomen bestaan helemaal niet; daar is de natuur niet aan toe gekomen. Dus: |
|||
| Hoofdschil 5 verdeelt zich in vier subnivo's |
van het type s p d f | met een maximaal aantal elektronen van: |
2, 6, 10 en 14 |
| Hoofdschil 6 verdeelt zich in drie subnivo's |
van het type s p d | met een maximaal aantal elektronen van: |
2, 6 en 10 |
| Hoofschil 7 verdeelt zich in twee subnivo's |
van het type s en p | met een maximaal aantal elektronen van: |
2 en 6 |

| Deeltje | Massa (g) | Massa (a.m.e) | Lading |
| Elektron | 9,1*10-28 | 0 | -1 |
| Neutron | 1,67495*10-24 | 1 | 0 |
| Proton | 1,67254*10-24 | 1 | +1 |
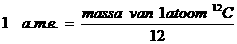
| Natrium | geel | Koper | groen | |
| Kalium | zwak violet | Tin | blauw | |
| Calcium | rood | Lood | zwak blauw |