Staalproductie
Hoogovens
Zoals gebruikelijk, eerst een link naar wikipedia over de staalproductie in hoogovens.
Daaruit nemen we enkele gegevens over en voegen er een en ander aan toe:
Een hoogoven is een installatie waarin ijzererts en koolstof worden gemengd en zo sterk verhit dat via een aantal chemische reacties vloeibaar ijzer ontstaat. Het koolstof dient tegelijkertijd als brandstof voor de verhitting en als reductiemiddel van het ijzererts.
Het (vloeibare) ijzer kan worden afgetapt en bevat een zeker percentage koolstof.
Geschiedenis
In China bestonden hoogovens vanaf ongeveer de vijfde eeuw voor Chr., in het Westen vanaf de Hoge Middeleeuwen. Hier verspreidde de hoogoven zich vanuit de regio rond de Waalse, aan de Maas gelegen stad Namen.
In 1491, aan het eind van de vijftiende eeuw werd de hoogoven in Engeland geïntroduceerd. De brandstof die in hoogovens werd gebruikt, was steevast houtskool.
Toen er gebrek ontstond aan hout(skool), ging men gebruik maken van cokes, aan het begin van de achttiende eeuw. Een eeuw later werd het proces versterkt door voorverwarmde lucht (dus zuurstof) in te blazen.
De moderne hoogoven
De temperatuur in de hoogoven kan zodanig worden opgevoerd, dat het product ijzer in vloeibare vorm kan worden afgetapt. Moderne hoogovens produceren 8.500 tot 12.000 ton ruwijzer per dag. In ons land waren de Hoogovens van IJmuiden beroemd, nu onderdeel van Tata Steel.
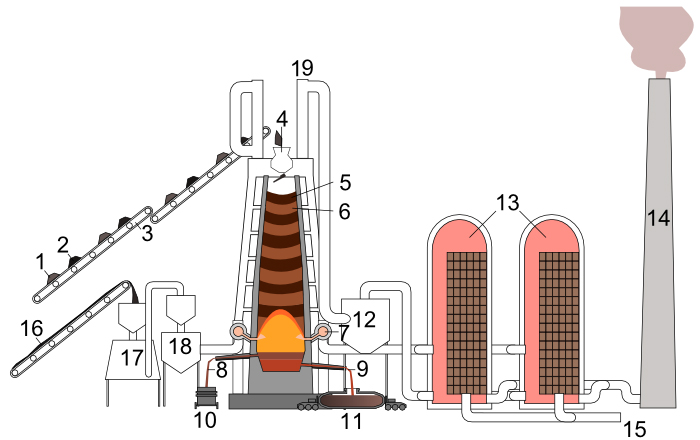
Bovenaan de hoogoven worden afwisselend lagen cokes (2,5) en lagen ruwe ijzererts met toevoegingen (1,6) ingeladen.
Beneden, aan de blaasmonden, wordt hete lucht (7, ongeveer 1200°C) en poederkool (16) ingeblazen, eventueel verrijkt met zuurstof.
De ijzeroxiden reduceren onder deze omstandigheden tot ijzer, dat bij die hoge temperatuur vloeibaar blijft. Dit vloeibaar ruwijzer sijpelt nu door de cokeslagen naar beneden en verzamelt zich onder in de hoogoven (de zogenaamde haard van de hoogoven).
Wanneer er zich voldoende vloeibaar ruwijzer heeft verzameld in de haard, wordt de hoogoven onderaan opengeboord en stroomt het vloeibaar ruwijzer (9) via het tapgat naar buiten. Daar wordt het opgevangen in mengers (11). Dit zijn treinwagons met een torpedovormig voorraadvat met vuurvaste binnenbekleding.
Deze worden getransporteerd naar de staalfabriek voor verdere verwerking.
Wanneer al het ruwijzer uit de hoogoven is afgetapt, wordt het tapgat weer dichtgemaakt. Het aftappen duurt ongeveer 90 minuten.
De ruwe ijzerertsen en hun toevoegingen bevatten - naast ijzeroxides - ook onzuiverheden waaronder calciumoxide (CaO) en siliciumdioxide (SiO2). Deze materialen vormen slak (8), die samen met het ruwijzer wordt afgetapt (10) en verwerkt in o.a. de cementindustrie.
Voor de productie van 1 ton ijzer in een hoogoven is gemiddeld 0,5 ton cokes nodig en 1,6 ton ijzererts met een ijzergehalte van 60%.
Hoogoven te IJmuiden

Hieronder nog een paar opmerkingen vanuit de theorie van scheikunde.
Een kernbegrip bij de productie van staal is: reductie.
In module 10 over redoxreacties komen we tegen dat reductie het omgekeerde is van oxidatie en dat die twee altijd tegelijk voorkomen:
Elektronen worden overgedragen van de reductor naar de oxidator
Reductie is dan eigenlijk: dat een stof gedwongen wordt om elektronen op te nemen.
In het hoogovenproces: IJzererts bevat Fe3+. Deze ionen worden gedwongen om per stuk drie elektronen op te nemen en zo neutraal IJzer te worden, Fe.
Die elektronen worden geleverd door de reductor CO, die bij dit proces wordt omgezet in CO2. Daarover het volgende:
Je herinnert je het begrip 'oxidatiegetal'?
Het oxidatiegetal van ijzer(III)ionen is +3 omdat het atoom Fe drie elektronen mist.
Het Koolstofatoom in CO heeft een ander oxidatiegetal dan in CO2.
In CO zit één C vast aan één O. Een O in een verbinding heeft oxidatiegetal -2. Dus moet die ene C oxidatiegetal +2 hebben.
In CO2 zit één Koolstofatoom vast aan twee O-atomen (elk 2-) dus moet dat ene Koolstofatoom hier een oxidatiegetal +4 hebben.
Dus is het oxidatiegetal van C tijdens de reactie veranderd van +2 naar +4. Dat kan alleen als het Koolstofatoom twee elektronen heeft afgestaan. Alleen zo kan dat atoom positiever worden. Daar zit dus de oxidator: het deeltje dat elektronen afstaat aan de reductor Fe3+.
Er moeten altijd evenveel elektronen worden afgestaan als opgenomen, dus de verhouding waarin het ijzer en het CO met elkaar reageren moet zijn: 2:3
Fe2O3(s) reageert dan ook met 3CO(g) of: twee ijzerionen reageren met twee koolstofatomen.
Hoogovens
Zoals gebruikelijk, eerst een link naar wikipedia over de staalproductie in hoogovens.
Daaruit nemen we enkele gegevens over en voegen er een en ander aan toe:
Een hoogoven is een installatie waarin ijzererts en koolstof worden gemengd en zo sterk verhit dat via een aantal chemische reacties vloeibaar ijzer ontstaat. Het koolstof dient tegelijkertijd als brandstof voor de verhitting en als reductiemiddel van het ijzererts.
Het (vloeibare) ijzer kan worden afgetapt en bevat een zeker percentage koolstof.
Geschiedenis
In China bestonden hoogovens vanaf ongeveer de vijfde eeuw voor Chr., in het Westen vanaf de Hoge Middeleeuwen. Hier verspreidde de hoogoven zich vanuit de regio rond de Waalse, aan de Maas gelegen stad Namen.
In 1491, aan het eind van de vijftiende eeuw werd de hoogoven in Engeland geïntroduceerd. De brandstof die in hoogovens werd gebruikt, was steevast houtskool.
Toen er gebrek ontstond aan hout(skool), ging men gebruik maken van cokes, aan het begin van de achttiende eeuw. Een eeuw later werd het proces versterkt door voorverwarmde lucht (dus zuurstof) in te blazen.
De moderne hoogoven
De temperatuur in de hoogoven kan zodanig worden opgevoerd, dat het product ijzer in vloeibare vorm kan worden afgetapt. Moderne hoogovens produceren 8.500 tot 12.000 ton ruwijzer per dag. In ons land waren de Hoogovens van IJmuiden beroemd, nu onderdeel van Tata Steel.

Bovenaan de hoogoven worden afwisselend lagen cokes (2,5) en lagen ruwe ijzererts met toevoegingen (1,6) ingeladen.
Beneden, aan de blaasmonden, wordt hete lucht (7, ongeveer 1200°C) en poederkool (16) ingeblazen, eventueel verrijkt met zuurstof.
2C(s) +O2(g)Zuurstof uit de lucht verbrandt de koolstof uit de cokes en het poederkool; daarbij ontstaat koolstofmonoxide (CO). Het CO gas, dat een temperatuur van ongeveer 2200-2400°C heeft, stijgt op door de lagen cokes en erts heen.2CO(g)
Fe2O3(s) + 3CO(g)3 CO2(g) + 2Fe(l) (Reductie van ijzeroxide tot ijzer)
De ijzeroxiden reduceren onder deze omstandigheden tot ijzer, dat bij die hoge temperatuur vloeibaar blijft. Dit vloeibaar ruwijzer sijpelt nu door de cokeslagen naar beneden en verzamelt zich onder in de hoogoven (de zogenaamde haard van de hoogoven).
Wanneer er zich voldoende vloeibaar ruwijzer heeft verzameld in de haard, wordt de hoogoven onderaan opengeboord en stroomt het vloeibaar ruwijzer (9) via het tapgat naar buiten. Daar wordt het opgevangen in mengers (11). Dit zijn treinwagons met een torpedovormig voorraadvat met vuurvaste binnenbekleding.
Deze worden getransporteerd naar de staalfabriek voor verdere verwerking.
Wanneer al het ruwijzer uit de hoogoven is afgetapt, wordt het tapgat weer dichtgemaakt. Het aftappen duurt ongeveer 90 minuten.
De ruwe ijzerertsen en hun toevoegingen bevatten - naast ijzeroxides - ook onzuiverheden waaronder calciumoxide (CaO) en siliciumdioxide (SiO2). Deze materialen vormen slak (8), die samen met het ruwijzer wordt afgetapt (10) en verwerkt in o.a. de cementindustrie.
Voor de productie van 1 ton ijzer in een hoogoven is gemiddeld 0,5 ton cokes nodig en 1,6 ton ijzererts met een ijzergehalte van 60%.
Hoogoven te IJmuiden

Hieronder nog een paar opmerkingen vanuit de theorie van scheikunde.
Een kernbegrip bij de productie van staal is: reductie.
In module 10 over redoxreacties komen we tegen dat reductie het omgekeerde is van oxidatie en dat die twee altijd tegelijk voorkomen:
Elektronen worden overgedragen van de reductor naar de oxidator
Reductie is dan eigenlijk: dat een stof gedwongen wordt om elektronen op te nemen.
In het hoogovenproces: IJzererts bevat Fe3+. Deze ionen worden gedwongen om per stuk drie elektronen op te nemen en zo neutraal IJzer te worden, Fe.
Fe3+ (aanwezig in ijzererts) + 3 e-Fe (eerst in het vloeibare, later gestolde ijzer)
Die elektronen worden geleverd door de reductor CO, die bij dit proces wordt omgezet in CO2. Daarover het volgende:
Je herinnert je het begrip 'oxidatiegetal'?
Het oxidatiegetal van ijzer(III)ionen is +3 omdat het atoom Fe drie elektronen mist.
Het Koolstofatoom in CO heeft een ander oxidatiegetal dan in CO2.
In CO zit één C vast aan één O. Een O in een verbinding heeft oxidatiegetal -2. Dus moet die ene C oxidatiegetal +2 hebben.
In CO2 zit één Koolstofatoom vast aan twee O-atomen (elk 2-) dus moet dat ene Koolstofatoom hier een oxidatiegetal +4 hebben.
Dus is het oxidatiegetal van C tijdens de reactie veranderd van +2 naar +4. Dat kan alleen als het Koolstofatoom twee elektronen heeft afgestaan. Alleen zo kan dat atoom positiever worden. Daar zit dus de oxidator: het deeltje dat elektronen afstaat aan de reductor Fe3+.
Er moeten altijd evenveel elektronen worden afgestaan als opgenomen, dus de verhouding waarin het ijzer en het CO met elkaar reageren moet zijn: 2:3
Fe2O3(s) reageert dan ook met 3CO(g) of: twee ijzerionen reageren met twee koolstofatomen.