Redoxreacties (koolstofchemie)
Ook in de koolstofchemie komen redoxreacties voor. Veel koolstofverbindingen zijn in staat om elektronen af te staan of op te nemen.
Let wel: als er hier over oxidatie wordt gesproken, dan wordt niet bedoeld de directe verbranding met zuurstof.
Haast alle stoffen uit de koolstofchemie zijn wel te verbranden tot koolzuurgas en waterdamp.
Oxidatiegetal Nox (koolstofchemie)
Je weet dat bij een redoxreactie de oxidatiegetallen van sommige elementen veranderen.
Bij redoxreacties in de koolstofchemie is dat oxidatiegetal niet altijd gemakkelijk vast te stellen. Waar vindt precies de elektronenoverdracht plaats, dat is de vraag, in het bijzonder ten aanzien van het koolstofatoom/atomen.
De redoxtabellen voorzien niet in halfreacties, dus de veranderingen van het oxidatiegetal zul je zelf moeten uitvogelen.
We nemen methanol als voorbeeld:
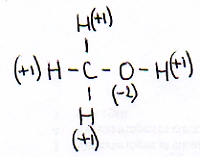
Normaal heeft een H in een verbinding het oxidatiegetal +1 en een O heeft Nox=-2
Deze twee gegevens ken je dus en ook moet je weten dat het hele molecuul neutraal is.
Zo kun je eenvoudig berekenen dat het oxidatiegetal van de C hier -2 moet zijn.
Het oxidatiegetal van koolstof in de volgende verbindingen:
Ook in de koolstofchemie komen redoxreacties voor. Veel koolstofverbindingen zijn in staat om elektronen af te staan of op te nemen.
Let wel: als er hier over oxidatie wordt gesproken, dan wordt niet bedoeld de directe verbranding met zuurstof.
Haast alle stoffen uit de koolstofchemie zijn wel te verbranden tot koolzuurgas en waterdamp.
Oxidatiegetal Nox (koolstofchemie)
Je weet dat bij een redoxreactie de oxidatiegetallen van sommige elementen veranderen.
Bij redoxreacties in de koolstofchemie is dat oxidatiegetal niet altijd gemakkelijk vast te stellen. Waar vindt precies de elektronenoverdracht plaats, dat is de vraag, in het bijzonder ten aanzien van het koolstofatoom/atomen.
De redoxtabellen voorzien niet in halfreacties, dus de veranderingen van het oxidatiegetal zul je zelf moeten uitvogelen.
We nemen methanol als voorbeeld:
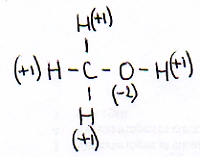
Normaal heeft een H in een verbinding het oxidatiegetal +1 en een O heeft Nox=-2
Deze twee gegevens ken je dus en ook moet je weten dat het hele molecuul neutraal is.
Zo kun je eenvoudig berekenen dat het oxidatiegetal van de C hier -2 moet zijn.
Het oxidatiegetal van koolstof in de volgende verbindingen:
| Ethaan | Beide C-atomen zijn -3 |
| ethanol | één C-atoom is -3 en de ander is -1 |
| ethanal | één C-atoom is -3 en de ander is +1 |
| ethoxi-ethaan | Twee C-atomen zijn -3 en twee andere zijn -1 |
| ethylethan(o)aat | Twee C-atomen zijn -3, één is +1 en één is +3 |
| methaan | Het C-atoom is -4 |