De reactie-orde definieert men als de som van de exponenten van de concentraties in de formule voor de snelheid V.
Normaal wordt deze exponent afgeleid van de coŽfficiŽnten in de reactievergelijking.
Neem de reactie: H2(g)+ Br2(g) 2HBr(g)
2HBr(g)
Dit lijkt een reactie van de tweede orde (bimoleculair), maar metingen van de snelheid tonen aan dat de orde van deze reactie = 1½.
Hoe leggen we dit uit?
De reactiestappen (met radikaal-mechanisme):
Stap 2, de traagste, is bepalend voor de totaalsnelheid:
Als we de twee (wiskundige) vergelijkingen combineren, kunnen we berekenen:
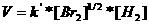
Dit betekent dat de reactie-orde gelijk moet zijn aan 1½ (zie exponent)
Normaal wordt deze exponent afgeleid van de coŽfficiŽnten in de reactievergelijking.
Neem de reactie: H2(g)+ Br2(g)
 2HBr(g)
2HBr(g)
Dit lijkt een reactie van de tweede orde (bimoleculair), maar metingen van de snelheid tonen aan dat de orde van deze reactie = 1½.
Hoe leggen we dit uit?
De reactiestappen (met radikaal-mechanisme):
- Br2
 2Br·
2Br·
dit evenwicht wordt gemakkelijke en snel bereikt - Br· + H2
 HBr + H·
HBr + H·
dit is de langzame stap - H· + Br2
 HBr + Br·
HBr + Br·
dit is de snelste stap
Stap 2, de traagste, is bepalend voor de totaalsnelheid:
| Vtotal = | 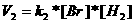 |
| Evenwicht 1 heeft als voorwaarde: | 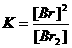 |
Als we de twee (wiskundige) vergelijkingen combineren, kunnen we berekenen:
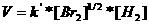
Dit betekent dat de reactie-orde gelijk moet zijn aan 1½ (zie exponent)