Zuiver jodium (soms noemt men het jood) is een vaste stof, opgebouwd uit donkerpaarse, bijna zwarte kristallen. Als je zo'n kristal vastpakt, hou je meteen bruine vlekken over op de huid van je vingers. Een beetje van het kristal is verdampt door de warmte van je huid en blijft in het vocht van je huid zitten met een bruine kleur.
Je zou moeten waarnemen wat er gebeurt als puur jodium verdampt. Jodium smelt namelijk niet, maar gaat van vast meteen over in damp, in gasvorm.
Als het oplost in alcohol krijg je jodiumtinctuur (te koop bij de drogist). Dit is het jodium dat prikt (omdat er alcohol in zit).
Er is ook een andere manier om jodium op te lossen: met een truukje in water, en dan prikt het niet als je er een wondje mee ontsmet.
Nu moet je het onderstaande schema bekijken / bespreken: je ziet modellen van verbindingen met waterstof van elementen uit de tweede periode van het periodiek systeem (C, N en O)
De binding tussen C en H is nauwelijks polair. De bindingen tussen O en H en de bindingen tussen N en H zijn polair genoeg.
Als een molecuul polaire bindingen bevat, dan zijn er de volgende twee mogelijkheden:
SO2 zal ongetwijfeld beter in (het polaire) water oplossen dan CO2
Polaire moleculen Dipool De mate waarin atomen geneigd zijn negatieve deeltjes, meestal elektronen, aan te trekken, noemt men ELEKTRONEGATIVITEIT (zie module 3). De elektronegativiteit wordt afgekort met de letter E.
Of die elektronen (die negatieve deeltjes) makkelijk of moeilijk worden aangetrokken door de neutrale atomen [en eventueel worden opgenomen] is o.m. afhankelijk van de kernlading (positieve lading) en van de atoomstraal (afstand).
Hoe groter de kernlading, des te sterker de aantrekkingskracht op de negieve deeltjes;
Hoe groter de afstand tot de kern, des te zwakker wordt die aantrekkingskracht.
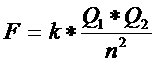
In het periodiek systeem neemt de kernlading van links naar rechts toe, terwijl het aantal hoofdschillen gelijk blijft. De buitenste hoofdschil wordt dus steeds sterker aangetrokken en het atoom wordt naar rechts kleiner.
Dit heeft tot gevolg dat de aantrekkingkracht van het atoom op de negatieve deeltjes (binnen en buiten het atoom) toeneemt en dat dus de elektronegativiteit gedurende ťťn periode van links naar rechts sterker wordt.
De atoomstraal wordt in het periodiek systeem van boven naar beneden groter omdat omdat er steeds een hoofdschil bij komt. Negatieve deeltjes (zoals elektronen) worden dan ook door de atomen van boven naar beneden steeds minder sterk aangetrokken omdat ze steeds verder van de kern verwijderd zijn.
Als een molecuul een asymmetrische ladingsverdeling heeft, dan heeft dat molecuul ook een zogenaamd dipoolmoment:
dipoolmoment = ladingsgrootte x afstand.
Met die afstand bedoelt men de afstand tussen de zwaartepunten van de ladingen.
De dipoolmomenten op van de vier waterstofhalogeniden zijn als volgt:
Als het dipoolmoment van een molecuul ongeveer 0 is, dan is deze stof apolair; zo niet, dan is de stof polair. Polaire stoffen hebben dipoolmoleculen.
Polaire stoffen, dus stoffen met ionen of stoffen met dipoolmoleculen, mengen goed met andere polaire stoffen; bijvoorbeeld: water met alcohol.
Apolaire stoffen mengen goed met apolaire stoffen; bijvoorbeeld: vet met olie.
Polaire stoffen mengen niet goed met apolaire stoffen (en andersom): water en olie.
Kortom:
"SOORT ZOEKT SOORT".
De aanwezigheid van ladingen in een molecuul zal de eigenschappen van dat molecuul sterk beÔnvloeden.
Als in ťťn molecuul of in een samengesteld ion twee gelijksoortige ladingen dicht in elkaars buurt zitten, beÔnvloeden ze elkaar: afstoting; daardoor krijgt de stof opvallende eigenschappen.
Een voorbeeld daarvan is ethaandizuur ofwel oxaalzuur:
De C - C binding in het midden staat onder grote spanning (door de afstotende werking van de positieve ladingen).
Dat verzwakt die C - C binding. Het gevolg is dat oxaalzuur (in tegenstelling tot gewone carbonzuren) vrij gemakkelijk kapot gaat = gemakkelijk te oxideren is.
Normaal is een C-C binding moeilijk stuk te krijgen.
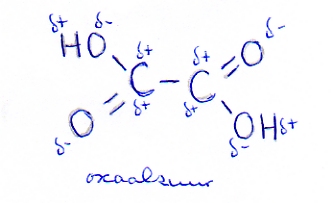
(Oxaalzuur is niet alleen een zuur, maar ook een geschikte reductor)
Een ander voorbeeld is: Kationzuur
Als je een ijzer(III)zout in water oplost, krijg je in het centrum een klein en sterk positief ijzer ion met dicht daaromheen een aantal watermoleculen.
De δ--kant van de zuurstofatomen wordt aangetrokken door dat positieve ijzerion. De enigzins positieve H-atomen van het water (de δ+-kant) komen dan vanzelf in de invloedssfeer van datzelfde ijzerion en ondervinden een afstotende kracht.
Er zijn zo een aantal complexe ionen die in staat zijn H+ af te splitsen en dus als een zwak zuur op te treden (kationzuur).
Je zou moeten waarnemen wat er gebeurt als puur jodium verdampt. Jodium smelt namelijk niet, maar gaat van vast meteen over in damp, in gasvorm.
Als het oplost in alcohol krijg je jodiumtinctuur (te koop bij de drogist). Dit is het jodium dat prikt (omdat er alcohol in zit).
Er is ook een andere manier om jodium op te lossen: met een truukje in water, en dan prikt het niet als je er een wondje mee ontsmet.
Nu moet je het onderstaande schema bekijken / bespreken: je ziet modellen van verbindingen met waterstof van elementen uit de tweede periode van het periodiek systeem (C, N en O)
| methaan | ammoniak | water | 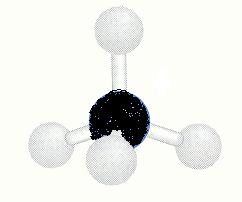 |
 |
 |
| CH4 | NH3 | H2O |
| tetraŽder geen dipool |
dipool | dipool |
| k.p. 112 K | k.p. 240 K | k.p. 373 K |
De binding tussen C en H is nauwelijks polair. De bindingen tussen O en H en de bindingen tussen N en H zijn polair genoeg.
Als een molecuul polaire bindingen bevat, dan zijn er de volgende twee mogelijkheden:
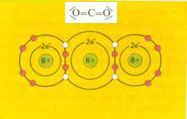
- De ruimtelijk opbouw van het molecuul is zodanig dat de zwaartepunten van positieve en negatieve ladingen niet samenvallen. Dit is het geval bij ammoniak en bij water.
- De zwaartepunten van de negatieve en positieve ladingen vallen (ongeveer) samen. Het beetje polair karakter van de bindingen tussen C en H in methaan levert geen dipoolmolecuul op. het molecuul is volkomen symmetrisch.
| symmetrisch: |
 |
| asymmetrisch: | 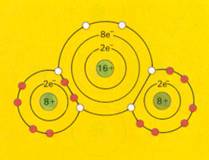 |
SO2 zal ongetwijfeld beter in (het polaire) water oplossen dan CO2
Polaire moleculen Dipool De mate waarin atomen geneigd zijn negatieve deeltjes, meestal elektronen, aan te trekken, noemt men ELEKTRONEGATIVITEIT (zie module 3). De elektronegativiteit wordt afgekort met de letter E.
Of die elektronen (die negatieve deeltjes) makkelijk of moeilijk worden aangetrokken door de neutrale atomen [en eventueel worden opgenomen] is o.m. afhankelijk van de kernlading (positieve lading) en van de atoomstraal (afstand).
Hoe groter de kernlading, des te sterker de aantrekkingskracht op de negieve deeltjes;
Hoe groter de afstand tot de kern, des te zwakker wordt die aantrekkingskracht.
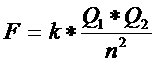
In het periodiek systeem neemt de kernlading van links naar rechts toe, terwijl het aantal hoofdschillen gelijk blijft. De buitenste hoofdschil wordt dus steeds sterker aangetrokken en het atoom wordt naar rechts kleiner.
Dit heeft tot gevolg dat de aantrekkingkracht van het atoom op de negatieve deeltjes (binnen en buiten het atoom) toeneemt en dat dus de elektronegativiteit gedurende ťťn periode van links naar rechts sterker wordt.
De atoomstraal wordt in het periodiek systeem van boven naar beneden groter omdat omdat er steeds een hoofdschil bij komt. Negatieve deeltjes (zoals elektronen) worden dan ook door de atomen van boven naar beneden steeds minder sterk aangetrokken omdat ze steeds verder van de kern verwijderd zijn.
Als een molecuul een asymmetrische ladingsverdeling heeft, dan heeft dat molecuul ook een zogenaamd dipoolmoment:
dipoolmoment = ladingsgrootte x afstand.
Met die afstand bedoelt men de afstand tussen de zwaartepunten van de ladingen.
De dipoolmomenten op van de vier waterstofhalogeniden zijn als volgt:
| bindingsafstand | dipoolmoment | |
| HF | 90 x10-12m | 6,4 |
| HCl | 130 x10-12m | 3,5 |
| HBr | 140 x10-12m | 2,7 |
| HI | 160 x10-12m | 1,4 |
Als het dipoolmoment van een molecuul ongeveer 0 is, dan is deze stof apolair; zo niet, dan is de stof polair. Polaire stoffen hebben dipoolmoleculen.
Polaire stoffen, dus stoffen met ionen of stoffen met dipoolmoleculen, mengen goed met andere polaire stoffen; bijvoorbeeld: water met alcohol.
Apolaire stoffen mengen goed met apolaire stoffen; bijvoorbeeld: vet met olie.
Polaire stoffen mengen niet goed met apolaire stoffen (en andersom): water en olie.
Kortom:
"SOORT ZOEKT SOORT".
De aanwezigheid van ladingen in een molecuul zal de eigenschappen van dat molecuul sterk beÔnvloeden.
Als in ťťn molecuul of in een samengesteld ion twee gelijksoortige ladingen dicht in elkaars buurt zitten, beÔnvloeden ze elkaar: afstoting; daardoor krijgt de stof opvallende eigenschappen.
Een voorbeeld daarvan is ethaandizuur ofwel oxaalzuur:
De C - C binding in het midden staat onder grote spanning (door de afstotende werking van de positieve ladingen).
Dat verzwakt die C - C binding. Het gevolg is dat oxaalzuur (in tegenstelling tot gewone carbonzuren) vrij gemakkelijk kapot gaat = gemakkelijk te oxideren is.
Normaal is een C-C binding moeilijk stuk te krijgen.
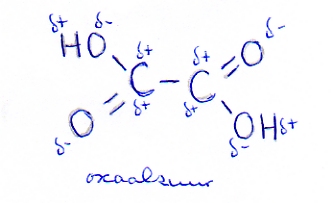
(Oxaalzuur is niet alleen een zuur, maar ook een geschikte reductor)
Een ander voorbeeld is: Kationzuur
Als je een ijzer(III)zout in water oplost, krijg je in het centrum een klein en sterk positief ijzer ion met dicht daaromheen een aantal watermoleculen.
De δ--kant van de zuurstofatomen wordt aangetrokken door dat positieve ijzerion. De enigzins positieve H-atomen van het water (de δ+-kant) komen dan vanzelf in de invloedssfeer van datzelfde ijzerion en ondervinden een afstotende kracht.
Er zijn zo een aantal complexe ionen die in staat zijn H+ af te splitsen en dus als een zwak zuur op te treden (kationzuur).