In het chemisch lab brengen we een klein stukje van het metaal natrium in gedestilleerd water (doen we in een soort aquarium).
Het Natrium is een zacht metaal waar we gewoon een stukje vanaf kunnen snijden of knippen, maar voorzichtig:
het wordt niet voor niets onder petroleum bewaard; het reageert spontaan met luchtzuurstof en met water.
Het afgeknipte stukje natrium drogen we (met filtreerpapier halen we het petroleum er af) en we leggen het voorzichtig op het wateroppervlak.
Meteen begint het hevig te reageren, er vormt zich een gas, het stukje natrium gaat snel bewegen over het wateroppervlak, al brandend met gele vlammen.
Dat gaat door tot het metaal helemaal verdwenen is.
Een paar druppels indicator toevoegen aan het water laat zien dat het gedestilleerd water basisch is geworden.
Dit is duidelijk een directe reactie: de natriumdeeltjes botsen direct met de waterdeeltjes en er zijn geen elektroden.
De reactie is zeer spontaan.
We volgen de zes stappen:
Het Natrium is een zacht metaal waar we gewoon een stukje vanaf kunnen snijden of knippen, maar voorzichtig:
het wordt niet voor niets onder petroleum bewaard; het reageert spontaan met luchtzuurstof en met water.
Het afgeknipte stukje natrium drogen we (met filtreerpapier halen we het petroleum er af) en we leggen het voorzichtig op het wateroppervlak.
Meteen begint het hevig te reageren, er vormt zich een gas, het stukje natrium gaat snel bewegen over het wateroppervlak, al brandend met gele vlammen.
Dat gaat door tot het metaal helemaal verdwenen is.
Een paar druppels indicator toevoegen aan het water laat zien dat het gedestilleerd water basisch is geworden.
Dit is duidelijk een directe reactie: de natriumdeeltjes botsen direct met de waterdeeltjes en er zijn geen elektroden.
De reactie is zeer spontaan.
We volgen de zes stappen:
- Een situatieschets:
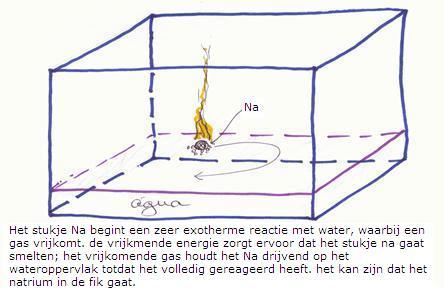
- de aanwezige deeltjes/stoffen zijn: natrium en water, verder niets.
Kijken we in de tabel, dan moeten we concluderen dat water zowel als oxidator en als reductor kan optreden (in beide gevallen zeer zwak).
Maar natrium daarentegen is een zeer sterke reductor, dus logisch om te denken dat het water in dit geval als oxidator gaat optreden.
De reductor staat hier lager dan de oxidator, dus de reactie is spontaan.
- De halfreactievergelijkingen:
Red: Na 
Na+ + e- |x2 Ox: 2H2O + 2e- 
H2 + 2OH- |x1
NB: het aantal elektronen moet in beide halfreacties gelijk zijn
- De totaalreactievergelijking:
2Na + 2H2O 2Na+ + H2 + 2OH-
2Na+ + H2 + 2OH-
of:
2Na(s) + 2H2O(l) 2NaOH(aq) + H2(g) ΔH < 0
2NaOH(aq) + H2(g) ΔH < 0
- Waarschijnlijk is hier één vervolgreactie: het waterstofgas dat ontstaat is verantwoordelijk voor de brand; het reageert met zuurstof uit de lucht en veroorzaakt de vlammen.
- Waarnemingen en conclusies:
- De reactie is spontaan, er komt energie vrij in de vorm van warmte en licht; het is dus exotherme reactie.
- Er vormt zich het gas waterstof dat gemakkelijk ontvlamt en zal branden; dat is te zien.
- Het product NaOH creëert een basisch milieu (ionen OH-); dat kunnen we controleren met de indicator: kleur wordt violet.