Kationzuren
Bepaalde meerwaardig positieve ionen (2+ en 3+) hebben de eigenschap om watermoleculen sterk aan te trekken. Ze worden gehydrateerd, zeggen we dan.
Er is een sterke aantrekking op de negatieve lading (δ-) van de watermoleculen. Maar ja, daarmee komen de waterstofatomen van die watermoleculen met hun lading δ+ ook dicht bij die sterk positieve metaalionen.
Je begrijpt dat dit afstoting tot gevolg heeft en dat er dan mogelijk protonen worden afgestoten.
kationzuren (=positief metaalion) met water
Zo ontstaat de mogelijkheid om H+ af te splitsen.
Het gaat hier om een aantal multipositieve metaalionen, zoals Al3+, Cu2+, Fe2+ of Fe3+, en andere.
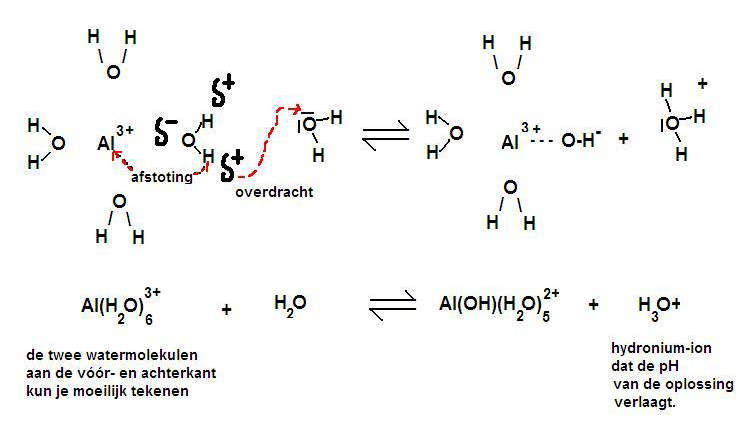
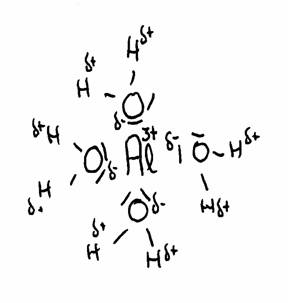
Het meest beroemde voorbeeld is het aluminium-ion in water opgelost, maar er zijn er veel meer.
Kationen zijn vrijwel altijd meerwaardige gehydrateerde positieve metaalionen:
Al(H2O)63+, Cu2+, Fe2+ of Fe3+, en nog veel meer andere, zijn altijd in water gehydrateerd.
De tekening laat de aantrekking zien tussen Al3+ en het δ- deel van zuurstof en het δ+ deel van waterstof.
De watermoleculen (in totaal 6) omgeven het 3+ ion van Aluminium omdat dit positieve ion de δ- van water om zich heen trekt.
Zodoende wordt de afstand tussen 3+ en δ+ steeds korter en daarmee de afstoting tussen 3+ en δ+ steeds sterker.
Het gevolg is dat de H min of meer kan worden afgestoten. Er kan afgifte zijn van H+-ionen, en dat noem je: een zuur karakter. (zie veel meer hierover in module 9)
Bepaalde meerwaardig positieve ionen (2+ en 3+) hebben de eigenschap om watermoleculen sterk aan te trekken. Ze worden gehydrateerd, zeggen we dan.
Er is een sterke aantrekking op de negatieve lading (δ-) van de watermoleculen. Maar ja, daarmee komen de waterstofatomen van die watermoleculen met hun lading δ+ ook dicht bij die sterk positieve metaalionen.
Je begrijpt dat dit afstoting tot gevolg heeft en dat er dan mogelijk protonen worden afgestoten.
kationzuren (=positief metaalion) met water  geconjugeerde base + hydroniumion.
geconjugeerde base + hydroniumion.
Zo ontstaat de mogelijkheid om H+ af te splitsen.
Het gaat hier om een aantal multipositieve metaalionen, zoals Al3+, Cu2+, Fe2+ of Fe3+, en andere.


Het meest beroemde voorbeeld is het aluminium-ion in water opgelost, maar er zijn er veel meer.
Kationen zijn vrijwel altijd meerwaardige gehydrateerde positieve metaalionen:
Al(H2O)63+, Cu2+, Fe2+ of Fe3+, en nog veel meer andere, zijn altijd in water gehydrateerd.
De tekening laat de aantrekking zien tussen Al3+ en het δ- deel van zuurstof en het δ+ deel van waterstof.
De watermoleculen (in totaal 6) omgeven het 3+ ion van Aluminium omdat dit positieve ion de δ- van water om zich heen trekt.
Zodoende wordt de afstand tussen 3+ en δ+ steeds korter en daarmee de afstoting tussen 3+ en δ+ steeds sterker.
Het gevolg is dat de H min of meer kan worden afgestoten. Er kan afgifte zijn van H+-ionen, en dat noem je: een zuur karakter. (zie veel meer hierover in module 9)