Een faseverandering is niet echt een chemische verandering, geen chemische reactie (hoewel het verschil niet altijd even duidelijk is).
Als er intern iets gebeurt met de deeltjes van de stof (ze ondergaan echte verandering) dan heb je een scheikundige reactie, maar als die deeltjes alleen maar veranderen in positie, trilling, energie, e.d. maar vanbinnen blijven ze gelijk, dan spreken we meer van fysische veranderingen. Dat kunnen dus faseveranderingen zijn.
Zo kunnen deeltjes in een rooster (vaste stof dus) op een paar manieren uit elkaar vallen:
De bekende faseovergangen zijn:
Het is leuk om op Youtube filmpjes over dit onderwerp te zoeken. bijvoorbeeld het volgende
Fase overgangen zijn dus niet altijd echte chemische reacties; ze behoren tot de natuurkundige verschijnselen. Let er dus op dat bijvoorbeeld koken iets heel anders is dan ontleden!!!! Dit wordt nogal eens door elkaar gehaald. Ook zijn er stoffen die bij verhitting niet smelten of koken, maar voortijdig gaan ontleden (bijv. suiker).
Een paar voorbeelden van veranderingen van aggregatietoestanden, faseveranderingen:
Gasvormige stoffen bij kamertemperatuur, over het algemeen, hebben geen of weinig aantrekkingskrachten tussen de deeltjes. Die zijn niet polair en hebben geen waterstofbruggen.
Wil je meer weten over de energie-effecten bij verandering van fase, klik dan hier
Als er intern iets gebeurt met de deeltjes van de stof (ze ondergaan echte verandering) dan heb je een scheikundige reactie, maar als die deeltjes alleen maar veranderen in positie, trilling, energie, e.d. maar vanbinnen blijven ze gelijk, dan spreken we meer van fysische veranderingen. Dat kunnen dus faseveranderingen zijn.
Zo kunnen deeltjes in een rooster (vaste stof dus) op een paar manieren uit elkaar vallen:
- Bij smelten (als een stof in droge vorm wordt verhit).
- Bij oplossen (gebeurt altijd in een oplosmiddel, zoals water)
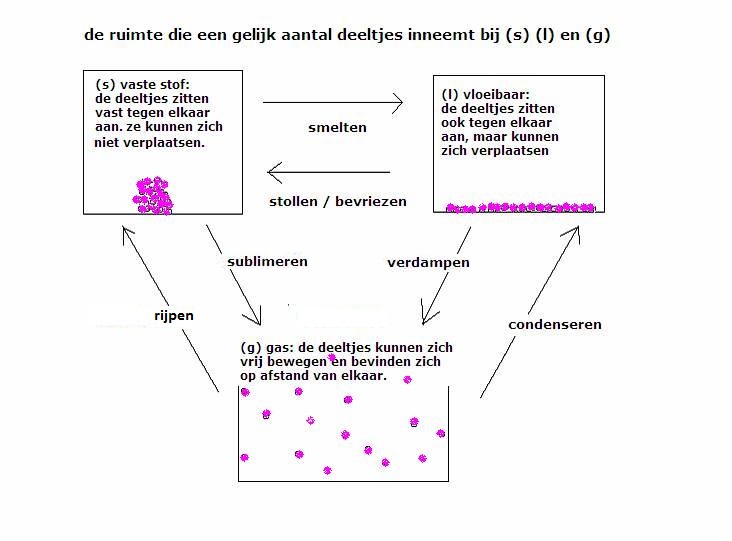
De bekende faseovergangen zijn:
(s)  (l) (l) |
smelten of stollen |
(l)  (s) (s) |
stollen |
(l)  (g) (g) |
koken / verdampen |
(g)  (l) (l) |
condenseren |
(l)  (g) (g) |
verdampen |
(s)  (g) (g) |
sublimeren |
(g)  (s) (s) |
desublimeren of rijpen |
Het is leuk om op Youtube filmpjes over dit onderwerp te zoeken. bijvoorbeeld het volgende
Fase overgangen zijn dus niet altijd echte chemische reacties; ze behoren tot de natuurkundige verschijnselen. Let er dus op dat bijvoorbeeld koken iets heel anders is dan ontleden!!!! Dit wordt nogal eens door elkaar gehaald. Ook zijn er stoffen die bij verhitting niet smelten of koken, maar voortijdig gaan ontleden (bijv. suiker).
Een paar voorbeelden van veranderingen van aggregatietoestanden, faseveranderingen:
- smelten van ijs: H2O(s)
 H2O(l)
H2O(l)
- benzine verdampt: C8H18(l)
 C8H18(g)
C8H18(g)
- lood kan ook smelten: Pb(s)
 Pb(l)
Pb(l)
Gasvormige stoffen bij kamertemperatuur, over het algemeen, hebben geen of weinig aantrekkingskrachten tussen de deeltjes. Die zijn niet polair en hebben geen waterstofbruggen.

Wil je meer weten over de energie-effecten bij verandering van fase, klik dan hier