Enzymstructuur
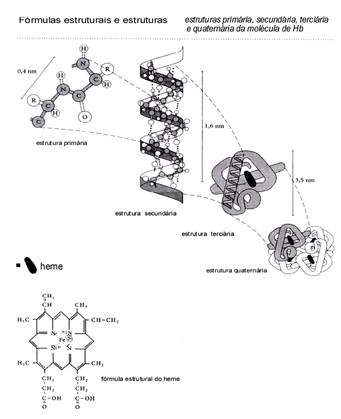
Vaak hebben de enzym-eiwitmoleculen een actieve plaats, een Co-enzym, zoals de heemgroep in het transportenzym hemoglobine (zie figuren). De twee substraten S1 en S2 verbinden zich heel specifiek aan het enzym. Andere moleculen passen gewoon niet (ruimtelijk gezien)
Regelmatig, maar niet in alle gevallen, bevindt zich in het actiecentrum van het enzym een co-enzym (zwak gebonden) of een prostetische groep (sterk gebonden).
Veranderingen van de vorm van het actiecentrum kan de enzymactiviteit sterk be´nvloeden, zelfs stil leggen.
Het centrum bevindt zich vaak in een soort spleet waarbinnen het vaak apolair is.
Coenzymen en prostetische groepen ( ) verbeteren de enzymactiviteit.
) verbeteren de enzymactiviteit.
Het complete enzym, inclusief de cofactoren en prostetische groepen, noemen we het holo-enzym,
Het enzym zonder cofactoren en prostetische groepen noemen we het apo-enzym.
Regelmatig is het co-enzym een vitamine, en hetzelfde co-enzym kan verschillende enzymen bedienen.
Sommige enzymen vereisen een anorganisch gedeelte, zoals een metaalionen (bijvoorbeeld, Ca2+, Mg2+ of Zn2+).
Deze anorganische component is een 'activator'. Funktioneel gezien is een activator gelijk aan een co-enzym, maar de anorganische componenten noemt met niet: co-enzymen.
<
br> Het enzym is - structureel gezien - een gewoon prote´ne met:

Vaak hebben de enzym-eiwitmoleculen een actieve plaats, een Co-enzym, zoals de heemgroep in het transportenzym hemoglobine (zie figuren). De twee substraten S1 en S2 verbinden zich heel specifiek aan het enzym. Andere moleculen passen gewoon niet (ruimtelijk gezien)
Regelmatig, maar niet in alle gevallen, bevindt zich in het actiecentrum van het enzym een co-enzym (zwak gebonden) of een prostetische groep (sterk gebonden).
Veranderingen van de vorm van het actiecentrum kan de enzymactiviteit sterk be´nvloeden, zelfs stil leggen.
Het centrum bevindt zich vaak in een soort spleet waarbinnen het vaak apolair is.
Coenzymen en prostetische groepen (
 ) verbeteren de enzymactiviteit.
) verbeteren de enzymactiviteit.
Het complete enzym, inclusief de cofactoren en prostetische groepen, noemen we het holo-enzym,
Het enzym zonder cofactoren en prostetische groepen noemen we het apo-enzym.
Regelmatig is het co-enzym een vitamine, en hetzelfde co-enzym kan verschillende enzymen bedienen.
Sommige enzymen vereisen een anorganisch gedeelte, zoals een metaalionen (bijvoorbeeld, Ca2+, Mg2+ of Zn2+).
Deze anorganische component is een 'activator'. Funktioneel gezien is een activator gelijk aan een co-enzym, maar de anorganische componenten noemt met niet: co-enzymen.
<
br> Het enzym is - structureel gezien - een gewoon prote´ne met:
- een primaire structuur, geproduceerd onder controle van DNA = de volgorde van de aminozuren
- een secundaire structuur, = de α-helix (schroef) van de primaire structuur
- een tertiaire structuur, = het resultaat als de α-helix zich opvouwt tot een driedimensionale vorm die de specificiteit van het enzym bepaalt evenals de manier waarop dit enzym geremd kan worden..
- een kwaternaire structuur (niet altijd aanwezig) is de samenvoeging van (vier) gelijke tertiaire structuren