elektroden
Hieronder zie je een schema van een eenvoudige chemische cel met koper/zink elektroden.
Bestudeer dit schema met aandacht:
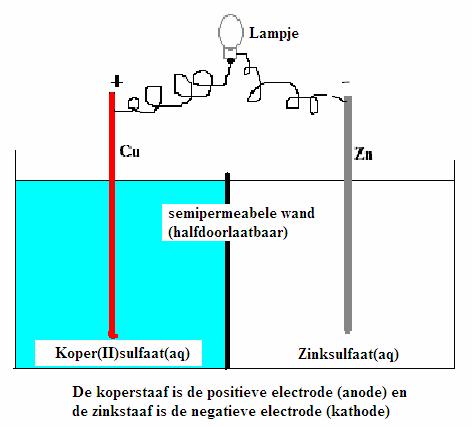
In dit complexe geheel kun je een voldoende sterke oxidator ontdekken (Cu2+) en ook een redelijk sterke reductor (Zn)
De (spontane) reacties die de boel domineren zijn:
Zn(s) Zn2+ + 2e-
Zn2+ + 2e-
en
Cu2+ + 2e- Cu(s)
Cu(s)
Je moet weten dat het realiseren van een redoxreactie aan het oppervlak van een elektrode vrijwel altijd een zekere activeringsenergie kost.
Zo'n reactie moet op gang gebracht worden.
Zeker als er bij de reactie gasvormige producten ontstaan, kan die activeringsenergie flink oplopen.
Indirecte redoxreacties vinden alleen plaats als er tussen de elektroden een omgeving is, een milieu, dat geleidend is voor elektrische stroom (d.w.z.: er moeten geladen deeltjes aanwezig zijn die vrij kunnen bewegen, zoals ionen van opgeloste of gesmolten zouten).
Je kunt ook zeggen dat de stroomkring bij de opstelling van een indirecte redoxreactie gesloten moet zijn. En deel van die stroomkring wordt gevormd door geleidende metaaldraden en elektroden met vrije elektronen en het andere deel wordt gevormd door een oplossing of gesmolten stof met vrije ionen.
Die vrije ionen kunnen bewegen tussen de positieve en negatieve elektrode.
Om deze beweging mogelijk te maken moeten de elektroderuimtes met elkaar in contact staan.
Dat kan met een halfdoorlatende wand (semipermeabel), of anders - als de twee elektroderuimten niet tegen elkaar aan staan - moeten die ruimten verbonden worden met een ionenbrug of beter: een zoutbrug. Dat is een soort buisje gevuld met zoutige gel (een gel met ionen).

Een elektrode kan gebrek hebben aan elektronen;
dan is die elektrode positief: anode
Een elektrode kan overschot hebben aan elektronen;
dan is die elektrode negatief: kathode
Kathode-Negatief // Anodo-Positief (KNAP)
Elektroden zijn gemaakt van geleidend materiaal: meestal een metaal, soms grafiet.
Deze stoffen bevatten vrije elektronen in een metaalrooster. Deze vrije elektronen kunnen vrij bewegen binnen de elektroden, van de negatieve naar de positieve kant = éénrichtingsverkeer).
Voorbeelden zijn: goud, platina en grafiet.
Anderzijds gebruikt men ook elektroden die gemaakt zijn van materiaal dat echt meedoet aan de redoxreactie, bijvoorbeeld in het geval van een ijzeren of zinken elektrode.
Een ijzerstaaf kan prima als elektrode dienen, maar zal ijzer-ionen in de oplossing sturen terwijl de elektronen in de staaf achterblijven.
Het is echt zo dat een elektrode die zo gebruikt wordt, langzaamaan dunner wordt en verdwijnt.
Het ijzer ondergaat daarbij de volgende halfreactie: Fe Fe2++2e-
Fe2++2e-
waarbij:
Een deelnemende (dus niet inerte) elektrode is altijd gemaakt van neutrale, niet-edele metalen; ze dienen als reductoren, oftewel, ze kunnen elektronen afstaan.
Het woord is al een paar keer gebruikt: "elektroderuimte"; dat is de ruimte direct rondom een anode of kathode, het oppervlak incluis.
Daar vinden de halfreacties plaats bij indirecte redoxreacties.
Het kan zijn dat de kathode- en anoderuimte niet fysisch gescheiden zijn, dus dat alles plaats vindt in één oplossing of vloeistof.
Om het overal gelijk te houden wordt er soms zelf continu geroerd in de oplossing.
Maar vaak is het anders: de twee processen verlopen gescheiden en de twee elektroderuimten worden zoveel mogelij apart gehouden, door semipermeabele wanden of met zoutbruggen.
Het moet semipermeabel zijn of er moet een zoutbrug zijn; zonder dat is er geen gesloten circuit en is stroomdoorgang onmogelijk (dus ook elektronenoverdracht).
In geval van een zoutbrug moet wel gezorgd worden dat de ionen van die zoutbrug zelf niet aan de redoxreactie meedoen.
De keuze voor of tegen gescheiden elektroderuimten heeft alles te maken met wat men wil van de betreffende redoxreactie.
Apart houden heeft meestal tot doel om de produkten niet bij elkaar te brengen.
Het zou namelijk kunnen dat die producten samen kunnen reageren, bijvoorbeeld, een neerslag vormen of een gas.
Maar het kan ook zijn dat iemand dat juist wil.
Een oplossing (of een gesmolten stof) geleidt elektriciteit alleen onder voorwaarde van de aanwezigheid van geladen beweeglijke deeltjes (ionen in dit geval).
De geleidbaarheid heeft alles te maken met de beweeglijkheid van die ionen: hoe beweeglijker, des te beter de geleidbaarheid.
Hieronder zie je een schema van een eenvoudige chemische cel met koper/zink elektroden.
Bestudeer dit schema met aandacht:

In dit complexe geheel kun je een voldoende sterke oxidator ontdekken (Cu2+) en ook een redelijk sterke reductor (Zn)
De (spontane) reacties die de boel domineren zijn:
Zn(s)
 Zn2+ + 2e-
Zn2+ + 2e-
en
Cu2+ + 2e-
 Cu(s)
Cu(s)
Je moet weten dat het realiseren van een redoxreactie aan het oppervlak van een elektrode vrijwel altijd een zekere activeringsenergie kost.
Zo'n reactie moet op gang gebracht worden.
Zeker als er bij de reactie gasvormige producten ontstaan, kan die activeringsenergie flink oplopen.
Indirecte redoxreacties vinden alleen plaats als er tussen de elektroden een omgeving is, een milieu, dat geleidend is voor elektrische stroom (d.w.z.: er moeten geladen deeltjes aanwezig zijn die vrij kunnen bewegen, zoals ionen van opgeloste of gesmolten zouten).
Je kunt ook zeggen dat de stroomkring bij de opstelling van een indirecte redoxreactie gesloten moet zijn. En deel van die stroomkring wordt gevormd door geleidende metaaldraden en elektroden met vrije elektronen en het andere deel wordt gevormd door een oplossing of gesmolten stof met vrije ionen.
Die vrije ionen kunnen bewegen tussen de positieve en negatieve elektrode.
Om deze beweging mogelijk te maken moeten de elektroderuimtes met elkaar in contact staan.
Dat kan met een halfdoorlatende wand (semipermeabel), of anders - als de twee elektroderuimten niet tegen elkaar aan staan - moeten die ruimten verbonden worden met een ionenbrug of beter: een zoutbrug. Dat is een soort buisje gevuld met zoutige gel (een gel met ionen).

Een elektrode kan gebrek hebben aan elektronen;
dan is die elektrode positief: anode
Een elektrode kan overschot hebben aan elektronen;
dan is die elektrode negatief: kathode
Kathode-Negatief // Anodo-Positief (KNAP)
Elektroden zijn gemaakt van geleidend materiaal: meestal een metaal, soms grafiet.
Deze stoffen bevatten vrije elektronen in een metaalrooster. Deze vrije elektronen kunnen vrij bewegen binnen de elektroden, van de negatieve naar de positieve kant = éénrichtingsverkeer).

Inerte en deelnemende elektroden:
Als het elektrodemateriaal van het type "zeer zwak" is (als reductor of oxidator stelt ie niets voor), dan zal deze elektrode INERT zijn. Het enige dat ie doet is elektronen transporteren, maar hij neemt niet deel aan de eigenlijke redoxreactie.Voorbeelden zijn: goud, platina en grafiet.
Anderzijds gebruikt men ook elektroden die gemaakt zijn van materiaal dat echt meedoet aan de redoxreactie, bijvoorbeeld in het geval van een ijzeren of zinken elektrode.
Een ijzerstaaf kan prima als elektrode dienen, maar zal ijzer-ionen in de oplossing sturen terwijl de elektronen in de staaf achterblijven.
Het is echt zo dat een elektrode die zo gebruikt wordt, langzaamaan dunner wordt en verdwijnt.
Het ijzer ondergaat daarbij de volgende halfreactie: Fe
 Fe2++2e-
Fe2++2e-
waarbij:
- Fe het ijzer is van de elektrode
- De Fe2+ -ionen de oplossing ingaan en zich vrij gaan bewegen in de richting van de negatieve elektrode
- De elektronen die achterblijven in de ijzerelektrode gaan meedoen aan de elektronenoverdracht en het elektronentransport.
Een deelnemende (dus niet inerte) elektrode is altijd gemaakt van neutrale, niet-edele metalen; ze dienen als reductoren, oftewel, ze kunnen elektronen afstaan.
Het woord is al een paar keer gebruikt: "elektroderuimte"; dat is de ruimte direct rondom een anode of kathode, het oppervlak incluis.
Daar vinden de halfreacties plaats bij indirecte redoxreacties.
Het kan zijn dat de kathode- en anoderuimte niet fysisch gescheiden zijn, dus dat alles plaats vindt in één oplossing of vloeistof.
Om het overal gelijk te houden wordt er soms zelf continu geroerd in de oplossing.
Maar vaak is het anders: de twee processen verlopen gescheiden en de twee elektroderuimten worden zoveel mogelij apart gehouden, door semipermeabele wanden of met zoutbruggen.
Het moet semipermeabel zijn of er moet een zoutbrug zijn; zonder dat is er geen gesloten circuit en is stroomdoorgang onmogelijk (dus ook elektronenoverdracht).
In geval van een zoutbrug moet wel gezorgd worden dat de ionen van die zoutbrug zelf niet aan de redoxreactie meedoen.
De keuze voor of tegen gescheiden elektroderuimten heeft alles te maken met wat men wil van de betreffende redoxreactie.
Apart houden heeft meestal tot doel om de produkten niet bij elkaar te brengen.
Het zou namelijk kunnen dat die producten samen kunnen reageren, bijvoorbeeld, een neerslag vormen of een gas.
Maar het kan ook zijn dat iemand dat juist wil.
Een oplossing (of een gesmolten stof) geleidt elektriciteit alleen onder voorwaarde van de aanwezigheid van geladen beweeglijke deeltjes (ionen in dit geval).
De geleidbaarheid heeft alles te maken met de beweeglijkheid van die ionen: hoe beweeglijker, des te beter de geleidbaarheid.
- hoeveel ionen zijn aanwezig?
- zijn ze groot of klein of erg gehydrateerd?
- Soms heeft een ion (zeker het H+-ion in water-omgeving) nog speciale technieken om de beweeglijkheid extra te vergroten.