Dipool
Dipoolmolecuul
De volgende afbeelding heb je al eerder gezien:
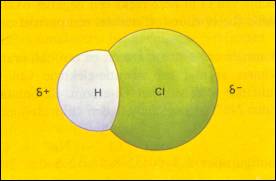
Moleculen kunnen één of meer polaire bindingen bevatten, en ze kunnen al dan niet een dipool zijn.
Dat hangt af van de symmetrie van het molecuul (bekijk de voorbeelden)
Voorbeelden:
Over het algemeen zullen polaire stoffen elkaar aantrekken en in andere polaire oplosmiddelen oplossen (bijvoorbeeld suiker in water).
Net zo kunnen we zeggen dat niet-polaire stoffen elkaar ook aantrekken en in elkaar oplossen (bijvoorbeeld vet in olie).
Polaire en apolaire stoffen mengen niet.

Moleculen kunnen één of meer polaire bindingen bevatten, en ze kunnen al dan niet een dipool zijn.
Dat hangt af van de symmetrie van het molecuul (bekijk de voorbeelden)
Voorbeelden:
| CS2 (ΔE = ±0) | CO2 (ΔE = ±1.0) | H2O (ΔE = ±1.3) |
| Covalente bindingen | Covalente bindingen | Covalente bindingen |
| Niet polaire moleculen | Niet polaire moleculen | Polaire moleculen |
| Er is geen dipool | Er is geen dipool | Dipool |
| Er zijn geen δ+ en δ- | Er zijn δ+ en δ- waarvan de zwaartepunten elkaar overlappen |
De zwaartepunten van δ+ en δ- overlappen elkaar niet (bevinden zich op afstand van elkaar) |
|
S=C=S
|
O = C = O
δ- δ+ δ- |
δ+
δ+
H H \ / O δ- |
Over het algemeen zullen polaire stoffen elkaar aantrekken en in andere polaire oplosmiddelen oplossen (bijvoorbeeld suiker in water).
Net zo kunnen we zeggen dat niet-polaire stoffen elkaar ook aantrekken en in elkaar oplossen (bijvoorbeeld vet in olie).
Polaire en apolaire stoffen mengen niet.