Le Chatellier & van ĹtHof
Dit zijn de namen van twee wetenschappers die (1888) het chemisch evenwicht uitvoerig onderzochten en tot de volgende conclusie kwamen, de volgende regel:
Als je van buitenaf een verandering aanbrengt aan een chemisch evenwicht
veroorzaakt dat een verschuiving van het evenwicht op zodanige manier
dat die uitwendige verandering tegengewerkt wordt,
zoveel mogelijk ongedaan wordt gemaakt.
Met andere woorden:
Als je een systeem in evenwicht verstoort,
zal dat systeem de neiging hebben om de effecten van die verstoring minimaal te maken.
Dat gaat net zolang door tot er een nieuw evenwicht is ingetreden.
Zo'n externe verandering, zo'n be´nvloeding zou bijvoorbeeld kunnen zijn:
Dit alles werd hierboven op een kwalitatieve manier bekeken.
Je kunt dezelfde effecten ook kwantitatief onderzoeken en bewijzen met behulp van de evenwichtsconstante.
Die heeft een vaste waarde en verandert niet, wat je ook aan het evenwicht doet (behalve temperatuursverandering).
Die bewijzen kun je leveren met wiskundige berekeningen.
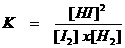
Stel bijvoorbeeld dat de hoeveelheid I2 verhoogd wordt.
Kijk naar de wiskundige formule voor K. Als de [I2] hoger wordt en K mag niet veranderen, dan moet, wiskundig gezien, ook de hoeveelheid HI hoger worden, dus moet het evenwicht zich verplaatsten.
Dit zijn de namen van twee wetenschappers die (1888) het chemisch evenwicht uitvoerig onderzochten en tot de volgende conclusie kwamen, de volgende regel:
Als je van buitenaf een verandering aanbrengt aan een chemisch evenwicht
veroorzaakt dat een verschuiving van het evenwicht op zodanige manier
dat die uitwendige verandering tegengewerkt wordt,
zoveel mogelijk ongedaan wordt gemaakt.
Met andere woorden:
Als je een systeem in evenwicht verstoort,
zal dat systeem de neiging hebben om de effecten van die verstoring minimaal te maken.
Dat gaat net zolang door tot er een nieuw evenwicht is ingetreden.
Zo'n externe verandering, zo'n be´nvloeding zou bijvoorbeeld kunnen zijn:
- ÚÚn van de stoffen wordt extra toegevoegd,
- het volume verandert
- er wordt warmte toegevoegd,
- of iets dergelijks.
- We veranderen de hoeveelheid van een aan het evenwicht deelnemende stof
bijvoorbeeld: waterstof toevoegen veroorzaakt een verschuiving van het evenwicht dat er voor zorgt dat (een deel van) dit extra waterstof weer (gedeeltelijk) verdwijnt, door de heenreactie te stimuleren.
Dit gaat door totdat er een nieuw evenwicht is bereikt.-

In de beker bevindt zich NH3(aq) (basisch milieu) met een paar druppels van de indicator methylrood,
waarvan de afgekorte formule is: HIn
Dan stelt zich in de oplossing het volgende evenwicht in:
HIn H++ In-
H++ In-
Rood Geel
De aanwezigheid van een base (die H+ opneemt) betekent een verschuiving van het evenwicht naar rechts
 de gele kleur domineert.
de gele kleur domineert.
-

Je voegt nu een beetje HCl(aq) toe, waardoor het basisch milieu verandert naar zuur milieu.
Het zuur wil H+ afstaan, dus:
het evenwicht: HIn H++ In-
H++ In-
Rood Geel
verplaatst zich naar links en de rode kleur gaat domineren.
-

Nu gaan we weer base toevoegen: (NH3(aq)), de kleur verandert weer naar geel
dus hetzelfde evenwicht verplaatste zich nu weer naar rechts:
HIn H++In-
H++In-
Rood Geel
-

Dit gedoe kun je eindeloos herhalen.
Elke keer zal het evenwicht verschuiven naar rechts of naar links.
De totaal-situatie in de beker verandert eigenlijk maar heel weinig.
Het is alleen maar een geringe verschuiving van het evenwicht naar de ene of ander kant, afhankelijk van de omgeving, het milieu.
-
- Het Volume veranderen
Een groter volume betekent dat er meer ruimte komt voor de deelnemende deeltjes in het evenwicht.
Hoe kan het systeem deze verandering tegenwerken? Hoe kan het systeem die meer ruimte voor deeltjes compenseren?
Het principe is dat zo'n verandering wordt tegengewerkt door het evenwicht, en dat kan alleen als er meer deeltjes worden gevormd.
Je kunt het volume op verschillende manieren veranderen:- bij gassen kan dat direct, door bijvoorbeeld een zuiger uit te trekken en de cylinder zo meer inhoud te geven
- bij vloeistoffen kun je verdunnen
In het voorbeeld van HI is dat niet mogelijk, want aan elke kant staan evenveel deeltjes. Verschuiving naar links of naar rechts levert dus niets op.
In dit geval heeft verandering van volume geen invloed op de ligging van het evenwicht.
- Warmte toevoegen of onttrekken
Als je extra energie toevoegt aan een chemisch evenwicht zal ook weer geprobeerd worden die verandering tegen te werken. In dit geval kan die toegevoegde warmte (voor een deel) worden opgebruikt door de endotherme reactie.
In het geval van HI zal het evenwicht zich naar links verplaatsen
[glucose + fructose saccharose + water ΔH < 0]
saccharose + water ΔH < 0]
Het saccharose-evenwicht is exotherm naar rechts.
Bij verlaagde temperatuur zal er dus minder energie beschikbaar zijn en wil het evenwicht energie "erbij maken".
Dat kan gerealiseerd worden met de exotherme reactie, dus met de reactie naar rechts. Oftewel, bij lagere temperaturen vormt zich meer saccharose.
Dit alles werd hierboven op een kwalitatieve manier bekeken.
Je kunt dezelfde effecten ook kwantitatief onderzoeken en bewijzen met behulp van de evenwichtsconstante.
Die heeft een vaste waarde en verandert niet, wat je ook aan het evenwicht doet (behalve temperatuursverandering).
Die bewijzen kun je leveren met wiskundige berekeningen.
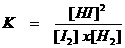
Stel bijvoorbeeld dat de hoeveelheid I2 verhoogd wordt.
Kijk naar de wiskundige formule voor K. Als de [I2] hoger wordt en K mag niet veranderen, dan moet, wiskundig gezien, ook de hoeveelheid HI hoger worden, dus moet het evenwicht zich verplaatsten.