Bimoleculaire reacties
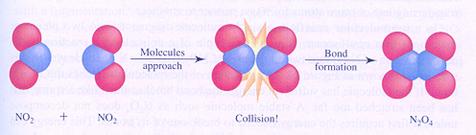
effectieve botsing
De meeste scheikundige reacties zijn bimoleculair: twee deeltjes moeten botsen en een effectieve botsing leidt dan tot een reactie.
Dat zijn geen elementaire reacties (zoals de unimoleculaire), ze hebben een gecompliceerd reactiemechanisme met diverse stappen.
Een bimoleculaire reactie verloopt niet automatisch succesvol bij elke botsing. De botsing moet 'effectief' zijn.
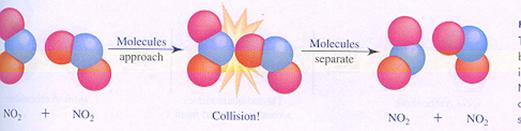
een niet effectieve botsing
Hieronder zie je in de afbeeldingen twee mogelijke (verschillende) mechanismen van de reactie tussen moleculen van stikstofdioxide. Je ziet verschillende stappen.
In geval I botsen twee moleculen en zo start de reactie.
In geval II splitst één molecuul en één van de producten botst met een ander molecuul.
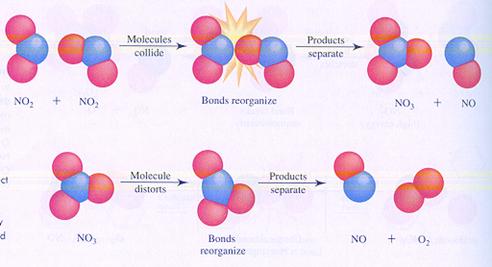
geval I
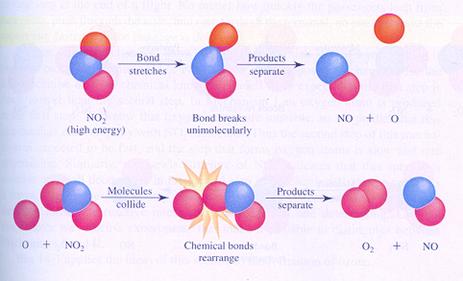
geval II

effectieve botsing
De meeste scheikundige reacties zijn bimoleculair: twee deeltjes moeten botsen en een effectieve botsing leidt dan tot een reactie.
Dat zijn geen elementaire reacties (zoals de unimoleculaire), ze hebben een gecompliceerd reactiemechanisme met diverse stappen.
Een bimoleculaire reactie verloopt niet automatisch succesvol bij elke botsing. De botsing moet 'effectief' zijn.

een niet effectieve botsing
Hieronder zie je in de afbeeldingen twee mogelijke (verschillende) mechanismen van de reactie tussen moleculen van stikstofdioxide. Je ziet verschillende stappen.
In geval I botsen twee moleculen en zo start de reactie.
In geval II splitst één molecuul en één van de producten botst met een ander molecuul.

geval I

geval II