Als twee niet-metalen met elkaar reageren, komen twee atoomsoorten bij elkaar die het liefst elektronen opnemen en negatief worden.
Niet metalen hebben immers al aardig wat elektronen in de buitenste schil. Voor hen is het gemakkelijker tot het voorkeursgetal 8 te komen door op te nemen.
Maar ja, allebei opnemen, hoe gaat dat, als er geen metalen in de buurt zijn die elektronen willen aanleveren?!
Toch kunnen de atomen van die niet-metalen allebei edelgasconfiguratie krijgen als ze een deel van elkaars valentie-elektronen gemeenschappelijk gaan gebruiken.
Om dat voor elkaar te krijgen moeten die atomen zeer dicht bij elkaar gaan zitten. Ze schuiven een beetje in elkaar.
Op deze manier kunnen ook niet-metalen wel degelijk met elkaar reageren.
Ook hier krijgen de valentie-elektronen daardoor meer bewegingsruimte (ze worden stabieler).
Omdat hierbij geen valentie-elektronen volledig worden overgedragen van de een naar de ander, kunnen er ook geen positieve of negatieve ionen ontstaan.
Er ontstaan dus hier geen ionbindingen.
Vergelijk in de volgende afbeeldingen twee stoffen: CO2 en SO2
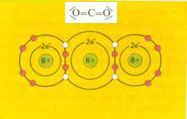
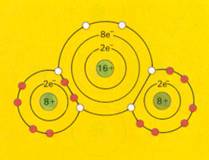
Beide atomen willen dus elektronen winnen, maar zo'n "win-win-situatie" kan alleen bij samenwerking.
Stel even dat twee niet-metalen met elkaar reageren; noem de twee niet-metalen P en Q.
Één atoom van P begint dan elektronen gemeenschappelijk te gebruiken met één atoom van Q. Ziedaar de start van de reactie.
Als éen van beide atoomsoorten dan nog geen edelgasconfiguratie heeft (normaal gesproken dus 8 valentie-elektronen, maar bij waterstof 2), wordt er een derde atoom bijgehaald. Dit gaat net zolang door tot alle erbij betrokken atomen edelgasconfiguratie hebben.
Daarbij is de regel dat gelijksoortige atomen liever niet aan elkaar koppelen (behalve C-atomen).
Als er dus zwavel- en zuurstofatomen bij elkaar komen, dan zullen atomen S en atomen O graag aan elkaar koppelen, liever dan twee S-atomen aan elkaar of twee O-atomen.
Niet metalen hebben immers al aardig wat elektronen in de buitenste schil. Voor hen is het gemakkelijker tot het voorkeursgetal 8 te komen door op te nemen.
Maar ja, allebei opnemen, hoe gaat dat, als er geen metalen in de buurt zijn die elektronen willen aanleveren?!
Toch kunnen de atomen van die niet-metalen allebei edelgasconfiguratie krijgen als ze een deel van elkaars valentie-elektronen gemeenschappelijk gaan gebruiken.
Om dat voor elkaar te krijgen moeten die atomen zeer dicht bij elkaar gaan zitten. Ze schuiven een beetje in elkaar.
Op deze manier kunnen ook niet-metalen wel degelijk met elkaar reageren.
Ook hier krijgen de valentie-elektronen daardoor meer bewegingsruimte (ze worden stabieler).
Omdat hierbij geen valentie-elektronen volledig worden overgedragen van de een naar de ander, kunnen er ook geen positieve of negatieve ionen ontstaan.
Er ontstaan dus hier geen ionbindingen.
Vergelijk in de volgende afbeeldingen twee stoffen: CO2 en SO2


Covalente bindingen = gemeenschappelijk gebruik van elkaars elektronen door twee atomen |
Stel even dat twee niet-metalen met elkaar reageren; noem de twee niet-metalen P en Q.
Één atoom van P begint dan elektronen gemeenschappelijk te gebruiken met één atoom van Q. Ziedaar de start van de reactie.
Als éen van beide atoomsoorten dan nog geen edelgasconfiguratie heeft (normaal gesproken dus 8 valentie-elektronen, maar bij waterstof 2), wordt er een derde atoom bijgehaald. Dit gaat net zolang door tot alle erbij betrokken atomen edelgasconfiguratie hebben.
Daarbij is de regel dat gelijksoortige atomen liever niet aan elkaar koppelen (behalve C-atomen).
Als er dus zwavel- en zuurstofatomen bij elkaar komen, dan zullen atomen S en atomen O graag aan elkaar koppelen, liever dan twee S-atomen aan elkaar of twee O-atomen.