| Deeltje | Massa (g) | Massa (a.m.e) | Lading |
| Elektron | 9,1*10-28 | 0 | -1 |
| Neutron | 1,67495*10-24 | 1 | 0 |
| Proton | 1,67254*10-24 | 1 | +1 |
Let op:
Het massagetal van een atoom is het totaal aantal kerndeeltjes.
Het atoomnummer van een atoom is het aantal protonen in de kern.
De massa van elektronen stelt niets voor als je die vergelijkt met de massa van nucleonen (van kerndeeltjes dus, protonen of neutronen).
Om de massa van een atoom vast te stellen hoef je alleen maar het aantal kerndeeltjes te tellen: dan krijg je het massagetal. Daarom zal een atoom dezelfde massa hebben als het bijbehorende ion. Dat ion heeft alleen maar een een of een paar elektronen meer of minder en die wegen praktisch niets.
Een element kan isotopen hebben. De atomen van dat element hebben een gelijk atoomnummer, maar verschillend massagetal. In de natuur zijn veel elementen samengesteld uit een paar isotopen. Die komen voor in een vaste verhouding.
De gemiddelde atoommassa van dat element wordt dan bepaald door de verhouding tussen die diverse isotopen. De waarden kun je normaal in tabellen vinden.
a.m.e. Atomaire massa-eenheid De massa van de materie (haar gewicht, zeg maar voor het gemak) zit voor het allergrootste deel in de kerndeeltjes, de protonen en neutronen. De elektronen wegen vrijwel niets; hun massa mag je op het geheel verwaarlozen.
Dat wil dus ook zeggen dat de massa van een deeltje direct afhangt van het aantal nucleonen in dat deeltje.
Een watermolecuul bevat 2 waterstof- en 1 zuurstofatoom
- elk atoom waterstof bevat 1 proton in de kern
- elk zuurstofatoom bevat 8 protonen en 8 neutronen in de kern
- een watermolecuul bevat dus 2 + 16 = 18 nucleonen (kerndeeltjes)
de atomaire massa-eenheid = het gemiddelde gewicht van één kerndeeltje (van één nucleon)Als dus een deeltje bijvoorbeeld 100 nucleonen bezit, dan zal de (molecuul)massa van dit deeltje 100 a.m.e. zijn.
- een watermolecuul bevat dus 2 + 16 = 18 nucleonen (kerndeeltjes)
 dus de massa van één molecuul water is 18 a.m.e.
dus de massa van één molecuul water is 18 a.m.e.
Om één gram materie te hebben (weegbaar op een weegschaal dus) heb je bij elkaar 6 x 1023 nucleonen nodig.
Atomaire massa-eenheid (ame) De atomaire massa-eenheid = a.m.e. = 1 u(nit)
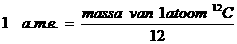
De waarden van atoommassa's kun je normaal in tabellen vinden.
zie bijvoorbeeld tabel V, kolom 4
De atoommassa baseert zich op de massagetallen van de verschillende isotopen die het element heeft.
Chloor bijvoorbeeld heeft, naast het atoom 35, nog een isotoop met 20 neutronen, dus met massagetal 37.
Het gemiddelde is niet 36, want in de natuur komt er drie keer zoveel 35Cl voor als 37Cl.
Uiteindelijk kun je berekenen dat de gemiddelde atoommassa van Chloor ongeveer 35,5 is.
Omdat elektronen voor de massa niet meetellen zit de atoommassa dus geconcentreerd in de atoomkern. Als je het aantal kerndeeltjes van een atoom kent, dan ken je automatisch ook de massa van dat atoom in u(nits).
Neem je dan vervolgens van die stof één mol (6.1023) atomen, dat weet je daarvan de massa in grammen.
Voorbeeld: Calcium (http://nl.wikipedia.org/wiki/Calcium)
- Calcium (40Ca)heeft 20 protonen en 20 neutronen; samen 40 a.m.e.
- 1 atoom Ca weegt dus 40 u.
- 6 x 1023 atomen Ca wegen dus 6.1023 x zoveel;
- 1 mol calciumatomen wegen 6.1023 x 40 u = 40 gram
40 is het aantal kerndeeltjes van een normaal calciumisotoop met 40 nucleonen)
Het getal 40,1 (atoommasse) op micro én op macronivo toepassen:
- één atoom calcium weegt gemiddeld: 40,1 u(nits){micronivo}
- één mol calcium weegt: 40,1 gram {macronivo}
Elk atoom heeft zijn eigen massagetal: de som van de kerndeeltjes.
De waarden van atoommassa's kun je normaal in tabellen vinden.
zie bijvoorbeeld tabel V, kolom 4
De atoommassa baseert zich op de massagetallen van de verschillende isotopen die het element heeft.
Avogadro 6.1023 kerndeeltjes (die samen dus 6.1023 u wegen) samen de massa hebben van één gram.
1 gram bevat dus 600.000.000.000.000.000.000.000 kerndeeltjes (nucleonen, dus de protonen en neutronen samen)
De gemiddelde massa van één kerndeeltje is gelijk aan 1,7.10-24 gram.
| getal van Avogadro = 6.1023 |