Chemische Industrie
Inleiding
Al die scheikunde uit de voorgaande modules wordt in het dagelijks leven toegepast. Ongelooflijk veel spullen die je regelmatig gebruikt, maar ook elke keer als je energie gebruikt, of nadat je wat gegeten hebt, dat alles heeft met de chemie te maken, vaak zonder dat je het beseft. De economie drijft er voor een belangrijk deel op, wat te zien is aan de chemische industrie.
Onze energie komt nog steeds voor een groot deel uit het verbranden van fossiele brandstoffen, maar ook als het via zonne-energie wordt opgewekt, speelt de scheikundige reactie een essentiële rol.
Elk schoonmaakmiddel dat je gebruikt, komt van een fabriek die de scheikundige processen kent van het schoonmaken. Zelfs de meeste voedingsmiddelen die je in supermarkt koopt, zijn met chemicaliën behandelt. En ga zo maar door.
In de chemische industrie worden al die onderdelen van de chemie, die je in voorgaande modules kunt vinden, toegepast. Een extra module over de chemische industrie in Nederland mag in deze cursus natuurlijk niet ontbreken. We zullen enkele belangrijke concrete voorbeelden behandelen.
Inhoud van de module
1. De kolencentrale
2. Staalproductie / Hoogovens
3. Kunststoffen
4. Aardgas
5. Aardolie(raffinaderij)
6.
7.
Een mooie beschrijving van de kolencentrale vind je bij wikipedia, op het Internet:
klik op: Kolencentrale
Een korte samenvatting volgt hieronder, hier en daar met wat toevoegingen.
Een kolencentrale is een thermische elektriciteitscentrale die met steenkool wordt gestookt.
De bijbehorende scheikundige reactie is eenvoudig:
C(s) + O2(g)  CO2(g)
CO2(g)
Vanzelfsprekend worden alle andere stoffen die in de steenkool zitten, mee verbrand. Daarbij moet je vooral denken aan Zwavel en Stikstof die bij verbranding oxiden opleveren: NO, NO2 en SO2. Deze oxiden kunnen in de lucht, met watere (regen) zuren veroorzaken (zure regen).
Behalve die gasvormige oxiden, ontstaat ook 'fijnstof', een soort vrijwel niet zichtbaar roet, allemaal slechte voor de volksgezondheid.
En er ontstaan grote hoeveelheden kooldioxide, CO2, dat niet zozeer de gezondheid schaadt, maar tot de broeikasgassen behoort. CO2 verhoogt de temperatuur op de aarde.
Kolencentrales worden om deze redenen als de meest milieuschadelijke vorm van energieopwekking beschouwd.
Op Internet kun je een mooi werkingsschema vinden van een kolencentrale in Zeeland
Bekijk het filmpje. Hieruit even apart genomen het onderstaande schema, dat je goed moet bestuderen. Zorg dat je precies doorhebt hoe de centrale in elkaar zit.
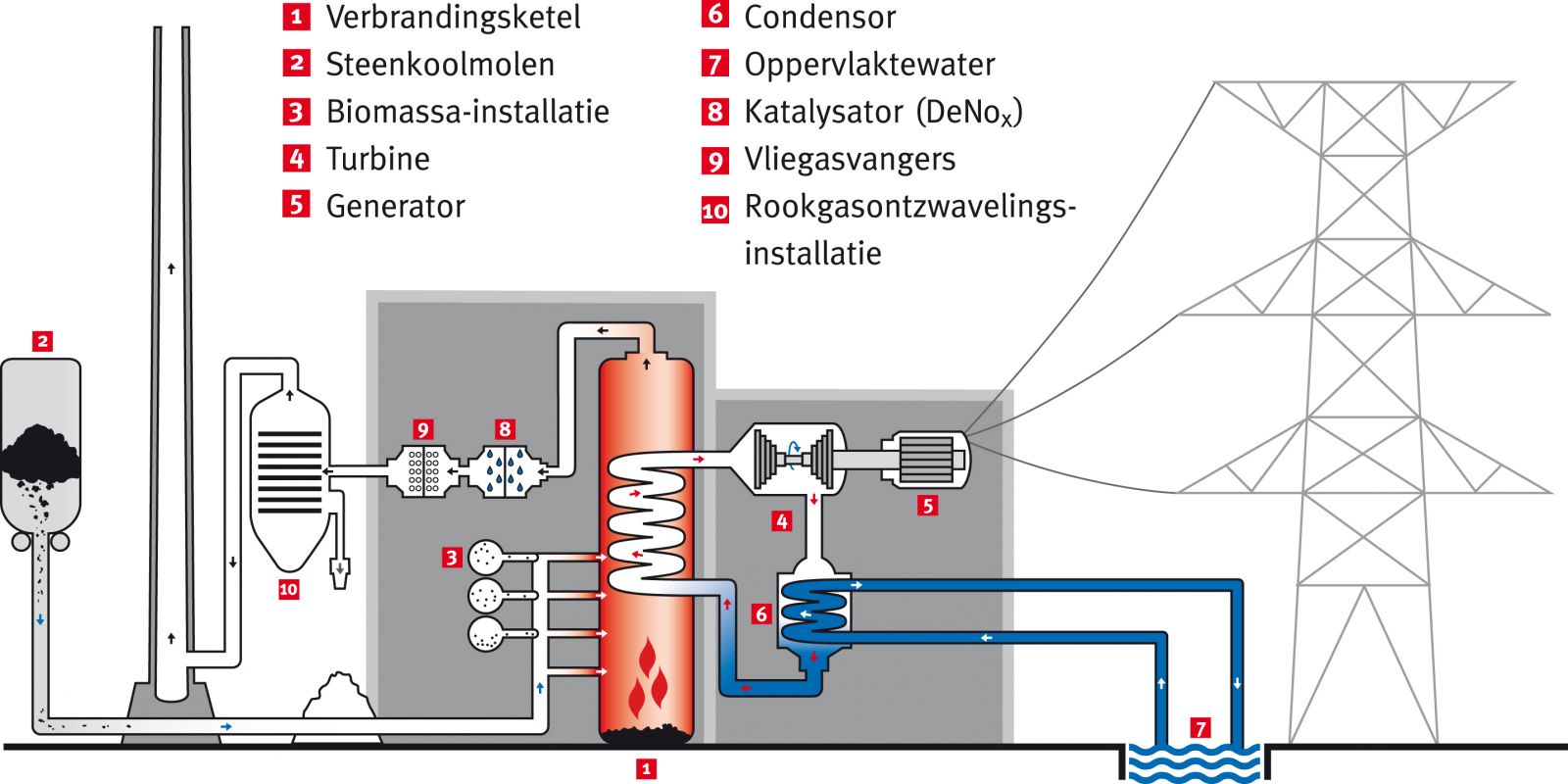
Zoals je ziet worden de kolen verbrand. Met de hitte die daarbij vrij komt, wordt stoom oververhit waarmee een turbine aan het draaien wordt gezet (een soort stoommachine dus). Aan die turbine zit een generator vast, die meedraait en zo stroom opwekt.
Maar je ziet dat er ook een grote hoeveelheid chemie aan te pas komt:
- De steenkool wordt soms van te voren zeer fijn vermalen, maar soms worden ze vergast. Vermalen of in gasvorm wordt de kool dan verbrand met zuurstof.
- stikstofoxiden worden 'afgevangen', zodat die niet in het milieu komen. Hierbij wordt een katalysator gebruikt
- as (die bij de verbranding overblijft) wordt opgevangen en afgevoerd
- zwaveloxiden worden 'afgevangen', zodat die niet in het milieu komen
Of dat allemaal goed gaat, en over wat er uit de centrale, ondanks al die instrumenten, toch ontsnapt zijn de meningen verdeeld.
In elk geval komt er heel veel kooldioxide in de atmosfeer, met klimaatveranderingen tot gevolg. Belangrijk is ook waar de steenkool vandaan komt. De kwaliteit ervan kan heel erg verschillen.
Om enig idee te krijgen over hoe enorm die machines zijn, de onderstaande foto, ook van Internet:

Op Internet vind je nog meer info, en wel over de kolencentrale in Amsterdam:
Interessant is hier dat ze er trots op zijn de uitstoot van de stikstofoxiden met 35% te verminderen. Bedenk daarbij wel dat dus 65% nog steeds in de lucht komt en dat is nogal wat!
Hieronder volgen een aantal extra scheikundige aspecten die met bovenstaande te maken hebben.
1.
Bij de verbranding komen dus stikstofoxiden vrij, vaak aangeduid met NOx. Die x slaat op het feit dat stikstof verschillende verbindingen met zuurstof kan maken:
NO, NO2, N2O3, N2O4, N2O5 en N2O (lachgas)
Met name de eerste twee komen nogal eens samen voor en worden 'nitreuze dampen' genoemd. NO2 is lichtbruin tot rood van kleur, NO is kleurloos en N2O4 (dat er soms ook in zit) heeft een lichtbruine kleur. Als je het inademt, merk je dat het verstikkend werkt, net als chloorgas.
Nitreuze dampen zijn sterk oxiderend en schadelijk voor de gezondheid.
2.
Bij het verbranden van steenkool kan het ook misgaan als er niet voldoende zuurstof wordt toegevoerd.
Normaal vormt zich kooldioxide (CO2), maar bij onvoldoende zuurstof kan ook koolmonoxide ontstaan (CO), een kleurloos en reukloos gas, maar zeer giftig. Het molecuul lijkt zo op zuurstofmoleculen dat de rode bloedlichaampjes "denken" dat het zuurstof is. Maar als CO daar eenmaal zit, wil het niet meer weg en blijft er steeds minder plaats voor zuurstof. Zo komt het zuurstoftransport stil te liggen met als gevolg een langzaam, maar dodelijk inslapen zonder dat je het in de gaten hebt.
2C(s) +O2(g)  2CO(g)
2CO(g)
In de steenkoolcentrales wordt elektrische energie opgewekt, waarbij gebruikt wordt gemaakt van chemische en fysische processen.
In dit geval is er sprake van een continuproces. De steenkool wordt, eventueel na vergruizing, continu aangevoerd voor verhitting/verbranding. Zo is de leverantie van elektrische stroom is zeer stabiel te regelen.
De grondstof is natuurlijk steenkool. De belangrijkste hulpstof is water, dat zelf niet mee reageert, maar wel bij de verbranding van steenkool op hoge temperatuur wordt gebracht.
Helaas zijn er nogal wat afvalstoffen, met name de oxiden van stikstof, zwavel en koolstof.
De chemische technologen zoeken ongetwijfeld naar de veiligste, maar ook naar de meest economische oplossing voor het proces. Alle (regel)apparatuur staat onder hun beheer en toezicht. Ze definiëren en controleren de chemische reacties
Zoals gebruikelijk, eerst een link naar wikipedia over de staalproductie in hoogovens.
Daaruit nemen we enkele gegevens over en voegen er een en ander aan toe:
Een hoogoven is een installatie waarin ijzererts en koolstof worden gemengd en zo sterk verhit dat via een aantal chemische reacties vloeibaar ijzer ontstaat. Het koolstof dient tegelijkertijd als brandstof voor de verhitting en als reductiemiddel van het ijzererts.
Het (vloeibare) ijzer kan worden afgetapt en bevat een zeker percentage koolstof.
Geschiedenis
In China bestonden hoogovens vanaf ongeveer de vijfde eeuw voor Chr., in het Westen vanaf de Hoge Middeleeuwen. Hier verspreidde de hoogoven zich vanuit de regio rond de Waalse, aan de Maas gelegen stad Namen.
In 1491, aan het eind van de vijftiende eeuw werd de hoogoven in Engeland geïntroduceerd. De brandstof die in hoogovens werd gebruikt, was steevast houtskool.
Toen er gebrek ontstond aan hout(skool), ging men gebruik maken van cokes, aan het begin van de achttiende eeuw. Een eeuw later werd het proces versterkt door voorverwarmde lucht (dus zuurstof) in te blazen.
De moderne hoogoven
De temperatuur in de hoogoven kan zodanig worden opgevoerd, dat het product ijzer in vloeibare vorm kan worden afgetapt. Moderne hoogovens produceren 8.500 tot 12.000 ton ruwijzer per dag. In ons land waren de Hoogovens van IJmuiden beroemd, nu onderdeel van Tata Steel.
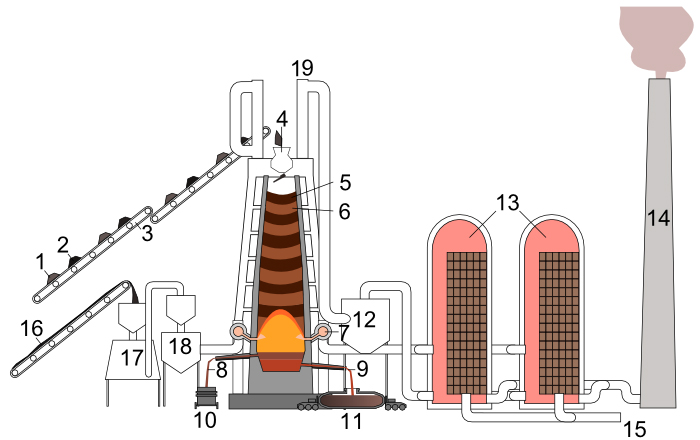
Bovenaan de hoogoven worden afwisselend lagen cokes (2,5) en lagen ruwe ijzererts met toevoegingen (1,6) ingeladen.
Beneden, aan de blaasmonden, wordt hete lucht (7, ongeveer 1200°C) en poederkool (16) ingeblazen, eventueel verrijkt met zuurstof.
2C(s) +O2(g)  2CO(g)
2CO(g)
Zuurstof uit de lucht verbrandt de koolstof uit de cokes en het poederkool; daarbij ontstaat koolstofmonoxide (CO). Het CO gas, dat een temperatuur van ongeveer 2200-2400°C heeft, stijgt op door de lagen cokes en erts heen.
Fe2O3(s) + 3CO(g)  3 CO2(g) + 2Fe(l) (Reductie van ijzeroxide tot ijzer)
3 CO2(g) + 2Fe(l) (Reductie van ijzeroxide tot ijzer)
De ijzeroxiden reduceren onder deze omstandigheden tot ijzer, dat bij die hoge temperatuur vloeibaar blijft. Dit vloeibaar ruwijzer sijpelt nu door de cokeslagen naar beneden en verzamelt zich onder in de hoogoven (de zogenaamde haard van de hoogoven).
Wanneer er zich voldoende vloeibaar ruwijzer heeft verzameld in de haard, wordt de hoogoven onderaan opengeboord en stroomt het vloeibaar ruwijzer (9) via het tapgat naar buiten. Daar wordt het opgevangen in mengers (11). Dit zijn treinwagons met een torpedovormig voorraadvat met vuurvaste binnenbekleding.
Deze worden getransporteerd naar de staalfabriek voor verdere verwerking.
Wanneer al het ruwijzer uit de hoogoven is afgetapt, wordt het tapgat weer dichtgemaakt. Het aftappen duurt ongeveer 90 minuten.
De ruwe ijzerertsen en hun toevoegingen bevatten - naast ijzeroxides - ook onzuiverheden waaronder calciumoxide (CaO) en siliciumdioxide (SiO2). Deze materialen vormen slak (8), die samen met het ruwijzer wordt afgetapt (10) en verwerkt in o.a. de cementindustrie.
Voor de productie van 1 ton ijzer in een hoogoven is gemiddeld 0,5 ton cokes nodig en 1,6 ton ijzererts met een ijzergehalte van 60%.
Hoogoven te IJmuiden

Hieronder nog een paar opmerkingen vanuit de theorie van scheikunde.
Een kernbegrip bij de productie van staal is: reductie.
In module 10 over redoxreacties komen we tegen dat reductie het omgekeerde is van oxidatie en dat die twee altijd tegelijk voorkomen:
Elektronen worden overgedragen van de reductor naar de oxidator
Reductie is dan eigenlijk: dat een stof gedwongen wordt om elektronen op te nemen.
In het hoogovenproces: IJzererts bevat Fe3+. Deze ionen worden gedwongen om per stuk drie elektronen op te nemen en zo neutraal IJzer te worden, Fe.
Fe3+ (aanwezig in ijzererts) + 3 e-  Fe (eerst in het vloeibare, later gestolde ijzer)
Fe (eerst in het vloeibare, later gestolde ijzer)
Die elektronen worden geleverd door de reductor CO, die bij dit proces wordt omgezet in CO2. Daarover het volgende:
Je herinnert je het begrip 'oxidatiegetal'?
Het oxidatiegetal van ijzer(III)ionen is +3 omdat het atoom Fe drie elektronen mist.
Het Koolstofatoom in CO heeft een ander oxidatiegetal dan in CO2.
In CO zit één C vast aan één O. Een O in een verbinding heeft oxidatiegetal -2. Dus moet die ene C oxidatiegetal +2 hebben.
In CO2 zit één Koolstofatoom vast aan twee O-atomen (elk 2-) dus moet dat ene Koolstofatoom hier een oxidatiegetal +4 hebben.
Dus is het oxidatiegetal van C tijdens de reactie veranderd van +2 naar +4. Dat kan alleen als het Koolstofatoom twee elektronen heeft afgestaan. Alleen zo kan dat atoom positiever worden. Daar zit dus de oxidator: het deeltje dat elektronen afstaat aan de reductor Fe3+.
Er moeten altijd evenveel elektronen worden afgestaan als opgenomen, dus de verhouding waarin het ijzer en het CO met elkaar reageren moet zijn: 2:3
Fe2O3(s) reageert dan ook met 3CO(g) of: twee ijzerionen reageren met twee koolstofatomen.
Heel veel informatie over dit onderwerp komt uit wikipedia. De tekst hieronder komt daar grotendeels vandaan.
Kunststoffen zijn opgebouwd uit zeer grote moleculen (macromoleculen). Die worden in de industrie op grote schaal gemaakt uit bepaalde grondstoffen die veel kleinere moleculen hebben. Je koppelt heel veel kleine moleculen aan elkaar en je krijgt dan 'polymeren'.
Niet elke kunststof is overigens een polymeer.
Het zijn hoe dan ook chemische verbindingen die meestal in fabrieken gemaakt worden door middel van scheikundige processen. De macromoleculen / polymeren die in de natuur worden gemaakt, zoals zetmeel of eiwit, reken je niet tot de kunststoffen.
Uit het Engels komt de naam 'plastic', dat in het Nederlands verwant is met 'plastisch': enigszins vervormbaar. Hier moet meteen bij gezegd worden dat zo'n naam wat misleidend is. Lang niet alle kunststoffen / plastics zijn vervormbaar.
Je kunt drie soorten onderscheiden:
-
Elastomeren (elastisch materiaal; je kunt het samendrukken, maar gaat toch weer terug naar zijn oorspronkelijke vorm. Een soort kunstrubber, elastiek, pur)
-
Thermoharders (als je die verhit, worden ze niet zacht, omdat de macromoleculen via dwarsverbindingen aan elkaar vast zitten. De moleculen zitten in een zeer stevig netwerk vast. Soms zijn ze bros. Ze worden ook wel 'duroplasten' genoemd.
Het is niet eenvoudig ze te maken; het proces wordt wel spuitgieten genoemd. Thermoharders recycleren (terugwinnen) is moeilijk.)
-
Thermoplasten (een kunststof die bij verwarming zachter wordt. De macromoleculen van thermoplasten liggen 'los' naast elkaar; dat wil zeggen: ze zijn niet met dwarsverbindingen aan elkaar gekoppeld. Ze hebben daarom enige bewegingsvrijheid t.o.v. elkaar. Ze worden 'plastisch', soepel.) Denk bijvoorbeeld aan vuilniszakken.
Polyetheen (PE)
Het polymeer polyetheen is de meest gebruikte kunststof (het meest bekende plastic). Ook de oudere naam polyethyleen wordt nog gebruikt. Het heet zo omdat het gemaakt wordt door etheen te koppelen in ketens.
Productieproces
Polyetheen wordt gemaakt door polymerisatie van etheen. Etheen wordt verkregen door het afbreken (kraken) van onder andere nafta, een licht derivaat van aardolie. Geschat wordt dat 1,2% van de ontgonnen aardolie gebruikt wordt om polyetheen te produceren.
Polyetheen wordt gesynthetiseerd door een radicalaire polymerisatie van etheen:
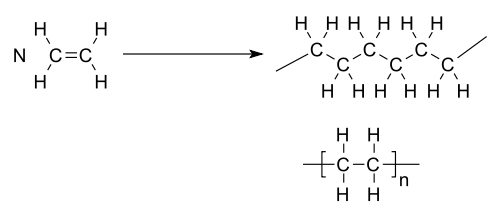
Giftigheid en milieubelasting
Zoals in bovenstaande molecuulformule van polyetheen te zien is, bevat het alleen koolstof- en waterstofatomen. Bij volledige verbranding in een afvalverbrandingsinstallatie ontstaan daaruit alleen de niet-giftige stoffen koolstofdioxide en water. Het verbranden van polyetheen levert dan ook geen direct gevaar op voor mens en milieu.
Echter, vooral bij brand in huis, bestaat het risico dat het polyetheen onvolledig verbrandt, waarbij naast koolstofdioxide het voor mens en dier giftige koolmonoxide ontstaat. Hiervan is bij de meeste organische materialen (stoffen die het element koolstof bevatten) sprake.
Net als andere kunststoffen wordt polyetheen niet snel door bacteriën afgebroken, waardoor het lang in het milieu kan rondzwerven.
Als het in het oppervlaktewater komt wordt het afgevoerd naar de zee en komt het na jaren in de oceanen terecht bij de zogeheten plasticsoep. Door de zeestroming wordt het afval daar naartoe gebracht en hoopt het zich op.
Daar staat tegenover dat het goed te recycleren is: het kan worden omgesmolten, want het is een thermoplast. Maar niet elk type polyetheen wordt ook echt gerecycleerd. Soms vindt men het economisch niet rendabel.
Classificatie van polyetheen
Polyetheen kan in twee verschillende processen worden gemaakt:
-
Hogedichtheidpolyetheen (HDPE of PE-HD) wordt gemaakt bij lage druk, met behulp van een katalysator.
Bij lage druk ontstaan lineaire ketens waardoor de stof kristallijn is opgebouwd. De dichtheid van HDPE ca. 0,95 tot 0,97 g/cm3. De dichtheid van LDPE ca. 0,91 tot 0,94 g/cm3. De dichtheid van LLDPE ca. 0,93 g/cm3. HDPE kan worden belast tot een temperatuur van 90 graden Celsius.
-
Lagedichtheidpolyetheen (LDPE of PE-LD) wordt bij hoge druk gemaakt, zo'n 200 MPa (= 2000 bar). Bij hoge druk ontstaat een polymeer met een hoge vertakkingsgraad waardoor de stof weinig kristallijn wordt. Een uitzondering is lineair lagedichtheidpolyetheen (LLDPE) dat wél hoofdzakelijk lineaire ketens bevat. LDPE kan worden belast tot een temperatuur van 70 graden Celsius.
Let op: Deze namen leiden frequent tot verwarring (merk op dat HDPE niet bij hoge druk wordt geproduceerd en LDPE wel).
UHPE of UHMWPE (Ultra High molecular weight PE) is een vierde variant. Dit type polyetheen wordt onder andere gebruikt voor de supersterke vezels zoals Dyneema®.
XLPE (Crosslinked polyethene) ontstaat door polyetheen te vulkaniseren, waardoor het eigenschappen krijgt van een elastomeer. XLPE wordt veel toegepast als isolatiemateriaal in elektriciteitskabels.
Toepassingen
Door het smelten van de korrel kan men deze omzetten in diverse eindtoepassingen zoals plastic flesjes, plastic zakjes, verpakkingsfilm, mantels van elektrische kabels, water- en gasleidingen en technische vezels.
Bij toepassing in flexibele waterleidingen met kleine diameter wordt LDPE ook wel aangeduid met 'tyleen'. Leidingen met grote diameter worden doorgaans gemaakt van PE100.
Steeds vaker zien we in vloerverwarming/vloerkoelingsinstallaties de variant PERT (Polyetheen Raised Temperature) toegepast.
Polypropeen
Polypropeen staat ook bekend onder de oudere benaming polypropyleen. Het is een thermoplastisch polymeer dat een zeer wijde toepassing kent, waaronder Australische bankbiljetten.
Eigenschappen
Polypropeen kan zeer zuiver worden gemaakt; dit maakt het geschikt voor de halfgeleiderindustrie. Het polymeer is goed bestand tegen chemische oplosmiddelen, basen en zuren. Het is ook bestand tegen bacteriegroei en daarom geschikt voor wegwerpspuiten en andere medische apparatuur.
Het polymeer kan heet in een vorm worden geperst, maar ook worden gezaagd/gefreesd en gelast.
Toepassingen
Polypropeen lijkt op polyetheen en is net zo goedkoop, maar het is veel sterker. In het dagelijks leven komen we het tegen in de vorm van plastic flessen (bijvoorbeeld jerrycans), tapijten, plastic meubelen, kleine open zeilbootjes en in veel auto-onderdelen. Andere toepassingen zijn pijpen, filtermateriaal, en plastic producten die een hogere kwaliteit vereisen dan zijn voorganger polyetheen kan bieden.
Polypropyleen wordt ook gebruikt als touw. Het voordeel van propyleen is dat het blijft drijven op het water. Bij boten is dit zeer handig omdat de lijn dan niet in de schroef van de boot kan komen. De meest voorkomende soort is een driestrengs geslagen lijn. Voor het maken van touw wordt polypropeenfolie in vezels gesneden. Het is een goede vervanger van natuurlijke touwen, als manilla, of hennep, omdat het een natuurlijke kleur heeft, vezelig en stroef is en bovendien blijft drijven op water. Hierom, en omdat het goedkoop en duurzaam is, worden polypropeentouwen vaak gebruikt bij scoutingboten. Polypropeentouwen worden vaak verkocht onder de merknaam Gripolene.
Polypropeen kan eenvoudig gerecycleerd worden.
Productieproces
Het polymeer polypropeen kan worden gemaakt door additiepolymerisatie van propeen.
Reactievergelijking van propeen en polypropeen
H H H H
H H H H
\ / \ /
| | | |
..+ C = C + C = C + ..  ~ C - C - C - C ~
~ C - C - C - C ~
/ \ / \
| | | |
CH3 H CH3 H
CH3 H CH3 H
Propeen Polypropeen
Polyvinylchloride (PVC)
Polyvinylchloride (pvc), met de systematische naam polychlooretheen, is een thermoplast die ontstaat na polymerisatie van het monomeer vinylchloride (chlooretheen).
Omdat pvc goedkoop en eenvoudig te bewerken is, wordt het veel toegepast in allerlei takken van de industrie ter vervanging van onder andere hout en beton.
Pvc is bekritiseerd vanwege de loodhoudende stabilisatoren en de gechloreerde koolwaterstoffen die bij verbranding vrijkomen. Medio 2006 is er een trend gaande om de loodhoudende stabilisatoren in het pvc te vervangen door organische en op tin gebaseerde stabilisatoren. Alle additieven moeten voldoen aan de Europese richtlijn REACH.
Pvc is bij toeval ontdekt in 1838. Er ontstond er een witte vaste stof nadat een fles vinylchloride werd blootgesteld aan zonlicht. In 1926 ontwikkelde Waldo Semon een methode om pvc te plasticeren door verschillende additieven toe te voegen. Het resultaat was een flexibel en eenvoudig te bewerken materiaal, waardoor het breed toepasbaar werd in vele commerciële producttoepassingen.
Synthese
Polyvinylchloride ontstaat na de polymerisatie van chlooretheen. De productie daarvan bestaat uit twee stappen. Eerst reageert etheen met chloor (Cl2) tot 1,2-dichloorethaan. Vervolgens wordt dit dichloorethaan geëlimineerd tot chlooretheen en waterstofchloride (HCl).
Ongeveer 30% van de wereldwijde chloorproductie wordt gebruikt voor deze productie.
Voor de polymerisatie worden chlooretheen en water gemengd in een reactor. Onder hoge druk en temperatuur vindt dan polymerisatie plaats; in dit geval betreft het een poly-additie.
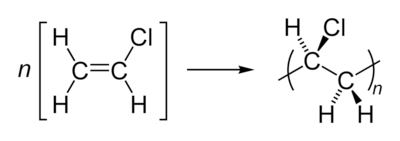
Daarna ondergaat het ruwe pvc enkele raffinagebewerkingen om uiteindelijk als poeder (resin) te worden afgeleverd. Dit resin wordt, onder toevoeging van additieven, verder verwerkt tot het eindproduct.
De verwerking van het ruwe pcv gebeurt bij hoge temperatuur (meestal 180 - 200 °C). Ter voorkoming van afbraak tijdens verwerking wordt een stabilisator toegevoegd. Een stabilisator bestaat uit bijvoorbeeld loodzouten zoals tribasisch loodsulfaat (PTS) of dibasisch loodfosfiet (PDF) (giftige stoffen). Tegenwoordig worden ook veel niet-toxische stabilisatoren (calcium- of zinkzouten) gebruikt.
Afhankelijk van de toepassing kunnen er andere additieven worden toegevoegd, bijvoorbeeld glijmiddelen (metaalstearaten, stearylstearaat) of vloeiverbeteraars (methacrylaten) voor een soepele verwerking, uv-stabilisatoren (benzofenonen, benzotriazolen) voor de lichtbestendigheid van raamprofielen, slagvastheidsadditieven (ABS) voor profielen of buizen, weekmakers (DEHP) voor tapijten of folies.
Toepassingen
Na de Tweede Wereldoorlog heeft het gebruik van pvc een grote vlucht genomen in het dagelijks leven. Bekende toepassingsvoorbeelden van pvc in het huishouden zijn buizen voor elektrische bedrading, behang (vinylbehang) en vloerbedekking zoals zeil. Ook wordt het wel toegepast in beschermende kleding, zoals chemische pakken en regenkleding.
In de medische wetenschap heeft pvc sinds de jaren vijftig rubber en glas grotendeels verdrongen in vooraf gesteriliseerde componenten. Belangrijkste redenen daarvoor zijn de chemische stabiliteit, inertheid en flexibiliteit.
Bloedinfuuszakken zijn gemaakt van weekgemaakt pvc met citraten.
De gebruikte weekmaker (ftalaat) heeft een conserverende werking op het bloed.
Schadelijke bijeffecten zijn onderzocht waarbij verregaande invloeden van ftalaten op hormonale- en neurale ontwikkeling zijn gevonden. Daarnaast kan het materiaal ook in het lichaam zelf worden gebruikt.
In de bouw- en auto-industrie wordt pvc veelvuldig toegepast in constructies, riolering, beschoeiing, coatings, dashboards en vloeren. Na polypropeen is het in de auto-industrie de meest gebruikte kunststof. Het is slijtvast, licht en herbruikbaar. Pvc is één van de belangrijkste grondstoffen voor kunststofkozijnen in Europa. Na gebruik worden deze kozijnen als grondstof gebruikt voor onder meer kunststof grond- en waterkeringen.
Omdat pvc in vrijwel elk denkbare vorm kan worden gegoten en in een breed scala aan kleuren te produceren is, wordt het vaak gebruikt in speelgoed. Zolang het materiaal aan strenge normen voldoet en geen schadelijke weekmakers en andere additieven bevat, is het zelfs voor jonge kinderen veilig te gebruiken.
Tenslotte zijn de verpakkingsindustrie en landbouw grote afnemers van pvc. Ook hier zijn prijs-prestatie-overwegingen veelal van doorslaggevend belang.
Tijdens de verbranding komt waterstofchloride of, afhangend van de zuurstofbalans, chloor, koolstofdioxide en water vrij.
Toxicologie en veiligheid van pvc
Van de meeste van pvc geproduceerde producten wordt aangenomen dat ze veilig te gebruiken zijn. Sommige additieven of weekmakers kunnen wel gevaar voor de gezondheid opleveren. In de EU zijn deze toevoegingen dan ook niet altijd toegestaan. Een en ander is afhankelijk van de toepassing.
In de jaren zestig is voor het eerst aangetoond dat de grondstof voor pvc, vinylchloride, kankerverwekkend kan zijn. Ook behoort het tot de risicofactoren voor het ontstaan van sclerodermie. Een ander nadeel is dat er bij de verbranding van pvc dioxines kunnen vrijkomen. Alhoewel het hier om zeer kleine hoeveelheden gaat, is bewezen dat dioxinen al in kleine hoeveelheden veranderingen kunnen veroorzaken in de hormoonhuishouding van organismen. Voor Greenpeace is dat reden om te streven naar het volledig uitbannen van pvc.
In de toepassingen als leidingssystemen (o.a. gas, afvalwater, drinkwater) is de ecologische impact van pvc echter duidelijk lager dan alternatieve materialen, zoals blijkt uit diverse studies.
Pvc-leidingsystemen hebben een levensduur van minstens 100 jaar. Na gebruik kan het gerecycled en hergebruikt worden.
Polyetheentereftalaat (PET)
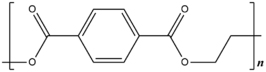
Structuurformule van polyethyleentereftalaat
PET is een vaste en kleurloze stof met een smeltpunt boven de 250°C en een dichtheid van 1,38 g/cm3
Let op: PET heeft niets te maken met PE (polyetheen)
Toepassingen
PET is een thermoplastische polyester, een kunststof die onder andere wordt toegepast voor het maken van petflessen en andere verpakkingen van voedingsmiddelen; voor industriële vezels en textielvezels (bijvoorbeeld: fleece); voor films en platen; voor keukengerei enz.
Het is een goede thermoplast: het laat zich onder verhitting gemakkelijk vervormen.
Het grootste voordeel van PET is dat het volledig recycleerbaar is.
Productie van PET
Polyesters worden bereid door de verestering van een dicarbonzuur met een diol, in dit geval van tereftaalzuur met ethyleenglycol.
Tereftaalzuur was vroeger moeilijk te verkrijgen in een hoge zuiverheid; daarom werd aanvankelijk de dimethylester (dimethyltereftalaat of DMT) ervan gebruikt.
Dat oorspronkelijke DMT-proces bestaat uit twee stappen, in aanwezigheid van geschikte katalysatoren.
- Eerste stap
Eerst gebeurt de reactie van gesmolten DMT met een overmaat ethyleenglycol. Dit is een omesteringsreactie, waarbij methanol vrijkomt. De overmaat ethyleenglycol wordt daarna afgedestilleerd.
C6H4(CO2CH3)2 + 2 HOCH2CH2OH
 C6H4(CO2CH2CH2OH)2 + 2CH3OH
C6H4(CO2CH2CH2OH)2 + 2CH3OH
- Tweede stap
nC6H4(CO2CH2CH2OH)2
 [(CO)C6H4(CO2CH2CH2O)]n + nHOCH2CH2OH
[(CO)C6H4(CO2CH2CH2O)]n + nHOCH2CH2OH
vervolgens gebeurt de polycondensatie tot hoogmoleculaire (molecuulmassa van 10.000 of meer) polyesters. Hierbij komt ethyleenglycol vrij.
In het TA-proces (van terephthalic acid) gebeurt de rechtstreekse verestering van tereftaalzuur met ethyleenglycol, waarbij water in plaats van methanol vrijkomt. De reactie gebeurt op hoge temperatuur (220-260°C, boven het kookpunt van ethyleenglycol), en onder druk (2,7-5,5 bar).
nC6H4(CO2H)2 + nHOCH2CH2OH
 [(CO)C6H4(CO2CH2CH2O)]n + 2nH2O
[(CO)C6H4(CO2CH2CH2O)]n + 2nH2O
Polymethylmethacrylaat
Molecuulformule: [CH2C(CH3)(CO2CH3)]n
Structuurformule (skelet) van PMMA-keten:
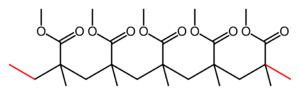
Deze stof is een polymeer van methylmethacrylaat, C5H8O2
Molecuulmassa: 100,1 g/mol, dichtheid: 1,2 g/cm3, transparant, maar kan gemakkelijk met kleurstof gekleurd worden, kan ontbranden boven de 250°C, goed oplosbaar in aceton en in ethylacetaat, niet oplosbaar in water.
Wordt ook wel Perspex of plexiglas genoemd. Het lijkt dus op glas, maar heeft een paar voordelen: lichter, versplintert niet, kan allerlei vormen aannemen, laat meer licht door dan glas. Daartegenover is plexiglas minder hard dan glas; het kan krassen. En het is brandbaar.
Synthese
De grondstoffen voor polymethylmethacrylaat zijn aceton, methanol, waterstofcyanide en zwavelzuur. Hoewel dit niet de vriendelijkste stoffen zijn, is het eindproduct onschadelijk. Bij een temperatuur boven de 450 °C verbrandt polymethylmethacrylaat volledig tot koolstofdioxide en water. Het productieproces werd in 1928 in verschillende laboratoria in Europa onafhankelijk van elkaar bedacht en in 1936 werd het op de markt gebracht.
Nylon (een polyamide)
Molecuulformule van de monomeer: C12H22N2O2, officiële naam: Polyhexametheenadipamide, dichtheid: 1,2 g/cm3 smeltpunt: 263°C
Structuurformule (skelet) en model:
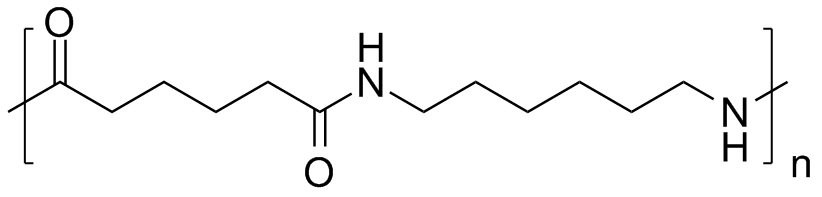
Nylon kent vele toepassingen: van panty tot kunstgewricht en van muurplug tot klimtouw. Nylon was de eerste commercieel succesvolle polymeer en is heden ten dage niet meer weg te denken in onze maatschappij.
Synthese
De meeste nylonsoorten worden gesynthetiseerd door condensatiepolymerisatie (polycondensatie) van een dicarbonzuur en een diamine. Er ontstaat een copolymeer waarbij de beide monomeren elkaar in de polymeerketen afwisselen. De bekendste variant is nylon-6,6: de eerste 6 staat voor de 6 koolstofatomen van het diamine (1,6-hexaandiamine) en de tweede 6 voor de 6 koolstofatomen van het dicarbonzuur (adipinezuur).
De klassieke laboratoriumsynthese van nylon 6,6:
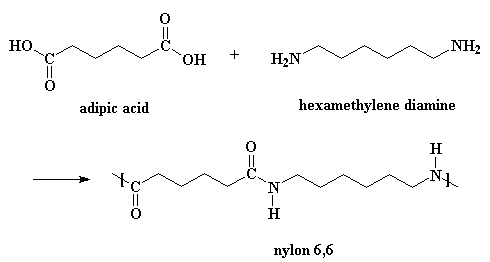
Een katalysator is niet echt nodig, maar zuren versnellen de reactie wel. En kijk, één van de reactanten is een zuur.
Voor meer info over deze reactie, bekijk het reactiemechanmisme
De nylonfilm ontstaat op het grensvlak van een waterige oplossing van 1,6-hexaandiamine en een organische oplossing van adipoyldichloride. Het ontstane polymeer kan met een haakje zacht uit de oplossing getrokken worden, terwijl steeds (doordat het contact tussen te twee lagen voortdurend wordt vernieuwd) verdere polymerisatie optreedt.
De algemene reactie voor de vorming van polyamide uit dicarbonzuur en diamine is:

Hierbij wordt naast nylon ook water gevormd.
In plaats van een dicarbonzuur kan ook een dizuurchloride gebruikt worden, dan wordt waterstofchloride (HCl) in plaats van water gevormd. Hier wordt meestal een base toegevoegd om het vrijkomende waterstofchloride weg te vangen.
Een andere, veel gebruikte nylonsoort is nylon-6. Deze soort wordt gemaakt door polymerisatie van caprolactam. Deze polymerisatie is geen condensatiepolymerisatie, maar een ringopeningspolymerisatie.
Structuur en eigenschappen
Belangrijke eigenschappen van nylons zijn de stijfheid en het smeltpunt. Deze worden bepaald door de krachten waarmee de koolstofketens elkaar aantrekken. Hoe sterker de moleculen elkaar aantrekken, hoe dichter ze in kristallijne vorm tegen elkaar zullen liggen en hoe moeilijker het zal zijn om de band tussen de ketens te verbreken met fysieke kracht of temperatuursverhoging. De aantrekkingskracht tussen de koolstofketens wordt mede bepaald door de waterstofbruggen tussen de CO- en de NH-groepen in naburige ketens.
Spuitgieten
Spuitgieten is een techniek om vorm te geven aan thermoplasten, thermoharders en metalen met een laag smeltpunt. Het gaat hier vooral over thermoplasten.
Met spuitgieten wordt kunststof dat aangevoerd wordt als granulaat of poeder, gesmolten tot een viskeuze massa. Die massa wordt onder hoge druk ingespoten in een matrijs waarvan de holte (of caviteit) de vorm is van het gewenste product. Door afkoeling stolt de kunststof en krijgt men het gewenste product. Spuitgieten is één van de meest gebruikte vormgevingstechnieken voor kunststof onderdelen.
Een spuitgietmachine:
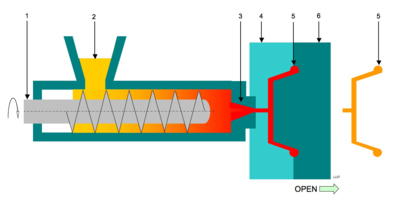
- Doseerschroef
- Granulaat
- Inspuitopening (spuitmond)
- Matrijs (onderdeel)
- Product
- Matrijs(bovendeel)
Een schroef (in een cilinder) (1) drukt het kunststof (granulaat) (2) door een kleine inspuitopening (spuitmond) (3) in de matrijs (4 & 6). Hierin bevindt zich een holte (caviteit) (5).
Het inmiddels gesmolten kunststof stroomt door de inspuitopening en vult de holten van het gereedschap.
Vervolgens wordt het gekoeld. Hierdoor stolt het materiaal en neemt het de vorm aan van de gereedschapsholten (5). De matrijs wordt, nadat het materiaal voldoende is afgekoeld, geopend door het boven deel (6) horizontaal te verplaatsen.
Vervolgens wordt het product, door de uitstoters (stiften) uit de geopende matrijs (4) gedrukt.
Door de zwaartekracht valt het product uit de matrijs in een opvangbak, of bij producten die niet mogen beschadigen pakt een robot ze uit de matrijs. Nadat het weer gesloten is kan aan de volgende productiegang begonnen worden.
Veel informatie over dit onderwerp is te vinden op wikipedia
Aardgas is een van de fossiele brandstoffen. Het ontstaat bij hetzelfde proces dat tot de vorming van aardolie leidt en vertegenwoordigt de lichtere fractie organische producten van dat proces. Aardgas wordt vaak samen met aardolie gevonden, hoewel soms het gas kans ziet in andere aardlagen door te dringen dan de veel zwaardere olie en er zo een scheiding kan zijn ontstaan.
In Europa wordt aardgas vooral in en rond de Noordzee aangetroffen, onder andere onder het noorden van Nederland. Aardgas uit het Groningse Slochteren bestaat voor 81,9% uit CH4 (methaan), voor 3,3% uit hogere gasvormige koolwaterstoffen, en voor de 14% uit stikstofgas en 0,8% kooldioxide.
Aardgas van andere winplaatsen heeft vaak een andere samenstelling en bevat soms ook waterstofsulfide ("zuur gas").
In het verleden is aardgas vaak als een afvalproduct beschouwd van oliewinning en eenvoudigweg 'afgefakkeld'. Ook nu gebeurt dit nog wel als het erg ver van de bewoonde wereld aangetroffen wordt en het transport naar de consument te veel problemen oplevert. Dit is ecologisch gesproken erg jammer omdat van de fossiele brandstoffen aardgas de schoonste soort is.
Affakkelen is echter wel beter dan het methaan simpelweg laten ontsnappen naar de atmosfeer omdat de bijdrage aan het broeikaseffect van methaan ca. 25 maal hoger is dan kooldioxide. Nog beter zou het zijn om het gas weer de bodem in te pompen. Dit is bijna altijd mogelijk maar vergt enige extra investering. In arme landen weigeren zowel regeringen als oliemaatschappijen vaak om deze investeringen te doen.
Methaan levert bij verbranding dubbel zoveel water als kooldioxide terwijl steenkool voornamelijk in kooldioxide wordt omgezet. Bovendien geeft aardgas vrijwel geen roet of as. Het is ook veel gemakkelijker dan steenkool of aardolie te ontdoen van onzuiverheden zoals zwavel met het Clausproces. Het is dan ook onbegrijpelijk dat er nog steeds steenkoolcentrales bestaan.
Geurstof
Schoon aardgas (ontdaan van de zwavelwaterstof (H2S) is reukloos. Om ervoor te zorgen dat weglekkend gas snel wordt opgemerkt, voegt men er een stinkstof aan toe. In Nederland wordt hiervoor 18 mg/m3 tetrahydrothiofeen toegepast, dat zorgt voor de welbekende gaslucht. Het spreekt vanzelf dat de geurstof bij verbranding reukloos dient te zijn. Belangrijk is dat men het gas al ruikt voordat het mengsel lucht-aardgas explosiegevaarlijk wordt. Op die manier is men tijdig gewaarschuwd en kan de nodige maatregelen nemen.
Toepassingen
Aardgas wordt als energiebron gebruikt om op te koken en om te verwarmen. Aardgas heeft in Nederland sinds de jaren zestig het stadsgas en het stoken op steenkool geheel verdrongen. Daarnaast wordt het in grootverbruik toegepast voor elektriciteitscentrales en stadsverwarming.
Elektriciteit geproduceerd met behulp van aardgas heeft het grootste aandeel in de in Nederland geproduceerde elektriciteit. Sinds een paar jaar (nu is het 2015) neemt het aantal kolencentrales weer toe, wat buitengewoon onverantwoordelijk is met het oog op de klimaatverandering.
Aardgas wordt ook als grondstof gebruikt in diverse chemische productieprocessen. DSM gebruikt aardgas om ammoniak mee te maken, dat op zijn beurt weer grondstof voor kunstmestfabricage is.
Methaan uit biovergisting
Het proces waarin methaangas gevormd wordt, hoeft geen duizenden jaren te duren, zoals voor olie en steenkool het geval is. Telkens wanneer organische stoffen anaeroob worden afgebroken, ontstaat methaan, tezamen met gassen als kooldioxide en waterstofsulfide. Dit natuurlijke proces treedt alleen op bij afwezigheid van zuurstof, omdat anders een composteringsproces voorrang krijgt.
Bij compostering ontstaat in principe geen methaangas.
In de natuur komt dit proces onder andere voor onder de waterspiegel van moerassen. Een andere vorm van dit proces is biovergisting waarbij biogas wordt gevormd, dat vervolgens gebruikt wordt om elektriciteit op te wekken. Daarnaast kan het biogas ook worden opgewerkt tot aardgaskwaliteit en ingevoed worden in het gasnet.
Ondergrondse waterstofopslag
Ondergrondse waterstofopslag is de opslag van waterstofgas in ondergrondse grotten, zoutkoepels of uitgeputte olie-en gasvelden. De opslag van grote hoeveelheden waterstof in ondergrondse mijnen, zoutkoepels, aquifers of uitgegraven rotsgrotten kan functioneren als energieopslagtechniek die noodzakelijk is voor de waterstofeconomie. In Nederland wordt dit (nog) niet gedaan. Het zou best eens kunnen dat opslag van waterstof in de oude gasbellen bij Groningen de druk daar een beetje op peil houdt en de aardbevingen (verzakkingen door drukverlaging) minder worden.
Veel informatie hierover is te vinden op: wikipedia
Raffinaderij
Schematische weergave van een destillatietoren.
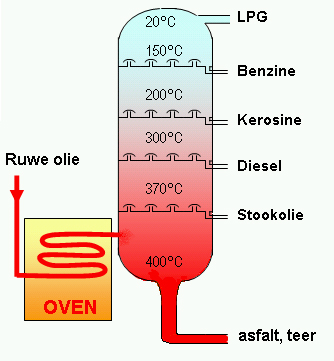
Fracties met een hoog kookpunt condenseren onderin de toren waar de temperatuur het hoogst is en fracties met een laag kookpunt condenseren pas bovenin de toren. Ruwe aardolie wordt hier gescheiden in een aantal verschillende bestanddelen (fracties) met oplopend molecuulgewicht. Dit geschiedt door een bijzondere vorm van destillatie, die fractionatie wordt genoemd.
Ook worden onzuiverheden uit de aardolie verwijderd. De hierbij ontstane producten dienen hetzij als brandstof, hetzij als basisgrondstof voor tal van producten (petrochemie), hetzij als smeermiddel of als grondstof voor de wegenbouw, dakbedekking, enzovoort.
flowdiagram van een moderne raffinaderij:
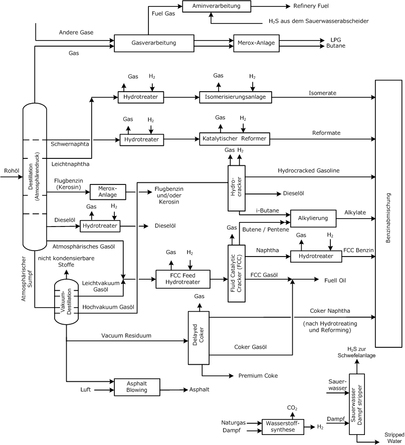
Een (aard)olieraffinaderij is een installatie voor de raffinage van aardolie tot bruikbare producten.

Geschiedenis
De oervorm van de aardolieraffinaderij kwam tot stand door de Amerikaan Samuel Kier in 1855. Het was niet meer dan een vat waarvan de inhoud op dezelfde wijze werd gedestilleerd als gebruikelijk in de alcoholindustrie. Het betrof een batchproces waarbij met het energetisch rendement nauwelijks rekening werd gehouden. Doel was de winning van kerosine, dat onder meer als lampolie (petroleum) werd ingezet. De lichtere fracties, voornamelijk benzine, werden als schadelijk en gevaarlijk ervaren. Het residu werd niet verder gefractioneerd, maar gewoonlijk verkocht als brandstof (gasolie).
Terwijl in Amerika weinig aandacht aan het energetisch rendement en aan de opbrengst werd besteed, omdat er aardolie in relatief grote hoeveelheden werd gewonnen, begon men in Europa aandacht aan dit probleem te schenken. Daar was de brandstof schaars en duur.
In 1871 werd in Galicië voor het eerst een systeem toegepast waarbij twee vaten bovenop elkaar werden gebruikt: In het onderste vat werd het residu opnieuw gedestilleerd, waarbij de zwaarste fracties (bitumen) werden afgescheiden en verwijderd. Hierbij werd, door Perutz, tevens een stap gezet in de richting van een continu proces. Slechts ééns in de vier dagen moest het proces worden stopgezet om de bitumen uit het benedenste vat te verwijderen.
In 1875 werd, door Fuhst, een systeem gebouwd dat bestond uit een aantal in serie geschakelde vaten, waartussen zich een systeem van overlooppijpen bevond. Het residu van het ene vat liep aldus in het volgende vat. Ook de koellichamen waren in serie geschakeld, teneinde het koelwater zo efficiënt mogelijk te gebruiken. De fracties hebben immers, naarmate ze zwaarder zijn, een hogere uitstroomtemperatuur aangezien hun kookpunt hoger ligt. De bedoeling van dit alles was tevens om herdestillatie (rectificatie) te vermijden. Dit laatste was nodig aangezien de producten van de primitieve raffinaderijen nog uit te veel verschillende fracties bestonden.
Het eerste volledig continue raffinageproces startte te Bakoe, in 1873, maar de douaneautoriteiten vertrouwden de zaak niet, daar ze belastingontduiking vreesden. In 1880-1881 bouwde Alfred Nobel een installatie die bestond uit 17 vaten en continu kon werken. Hij vroeg er patent op aan. Vanuit Oost-Europa verspreidde de technologie zich, en weldra werd ze ook in Nederlands-Indië toegepast door de voorlopers van Shell.
Langzamerhand werden negen productgroepen onderscheiden, en wel:
- Raffinaderijgassen (propaan, butaan, pentaan)
- Benzine
- Kerosine of petroleum
- Smeerolie
- Smeervet
- Mineraalolie
- Paraffine
- Bitumen
- Stookolie
Lang bleef kerosine het belangrijkste product, terwijl een beperkte afzet bestond voor stookolie, smeeroliën en paraffine. Een reeks uitvindingen, waaronder de verbrandingsmotor, zouden dit beeld ingrijpend veranderen. Vanaf het tweede decennium van de 20e eeuw ontwikkelde zich bovendien de petrochemie, waardoor een aantal lichte producten onder de naam nafta (ook: raffinaderijbenzine genaamd) een nuttige bestemming kregen.
Verdere ontwikkelingen
Een belangrijk kenmerk van een aardolieraffinaderij is haar flexibiliteit. Dit houdt in dat de raffinaderij in staat moet zijn om verschillende soorten ruwe aardolie - die sterk in samenstelling kunnen verschillen - te verwerken en tevens om, afhankelijk van de vraag, de gewenste producten in de juiste verhouding te kunnen leveren. Aangezien de samenstelling van de ruwe olie gegeven is, en slechts beïnvloed kan worden door de diverse soorten te mengen, heeft men ook getracht processen te ontwikkelen waarbij de ene fractie in de andere kan worden omgezet.
Van belang hierbij is het kraken, waarbij met behulp van een katalysator (katalytisch kraken), en waterstof (hydrocracking) de zwaardere koolwaterstoffen in lichtere koolwaterstoffen worden omgezet, bijvoorbeeld met als doelstelling om de opbrengst aan benzine te vergroten.
Werden deze processen al vanaf het eind van de 19e eeuw ontwikkeld, processen als katalytische reforming (met platina als katalysator) ontstonden vanaf 1940. Dit had mede te maken met de toegenomen behoefte aan benzine tijdens de Tweede Wereldoorlog. Hierbij werd nafta omgezet in complexere verbindingen, zoals aromatische verbindingen en vertakte ketens (isomerisatie). Dit leverde niet alleen benzines met een hoog octaangetal op, doch bovendien ook grondstoffen voor de petrochemische industrie.
Tot de hulpprocessen kunnen worden gerekend: ontzwavelingsinstallaties en waterstoffabrieken, waarbij zware fracties via vergassing in syngas worden omgezet, waaruit het waterstofgas gewonnen kan worden dat in de kraakprocessen wordt gebruikt.
Destillatie van ruwe aardolie
Elke stof in ruwe olie heeft zijn eigen kookpunt. Daarom wordt de olie verhit tot maximaal ongeveer 350-370°C waarbij de olie overgaat in dampvorm. De oliedampen worden in een destillatietoren (ook: destillatiekolom) geleid. De dampen stijgen op door de destillatietoren en worden tegelijkertijd afgekoeld. De zwaarste stoffen hebben een hoog kookpunt, de lichtere stoffen een laag kookpunt. De zwaardere stoffen zullen dus eerst condenseren. De lichtere stoffen stijgen verder door de toren. Uiteindelijk krijgt men op bepaalde plaatsen in de toren producten die aan de gewenste eigenschappen voldoen.
| fractie |
temperatuur |
C atomen
per molecuul |
| gas |
<20°C |
1-4 |
| lichte nafta |
20-80°C |
5-6 |
| zware nafta |
80-175°C |
7-10 |
| kerosine |
175-260°C |
10-14 |
| gasolie |
220-350°C |
9-25 |
| residu |
>350°C |
>25 |
Hydro-treating (behandeling met waterstof)
Lastige atomen (zoals: S, N, O) uit de ruwe aardoliefracties worden verwijderd door een reactie met waterstof waarbij de C-S, C-N en de C-O verbindingen worden gebroken.
Het doel van hydrotreating is:
- beschermen van katalysatoren tegen vergiftiging
- verbetering van de eigenschappen
- bescherming van het milieu
Vooral gasolie bevat veel zwavel. Indien deze niet wordt verwijderd treedt er luchtvervuiling op met SO2 dat zorgt voor zure regen. Deze zwavel moet bovendien verwijderd worden omdat anders een product als bijvoorbeeld nafta onbruikbaar is voor verdere bewerking. De zwavel zit ingebed in zogenaamde thiolgroepen. Door toevoeging van o.a. waterstof en een katalysator wordt de zwavel uit de thiolen gehaald en omgezet in waterstofsulfide dat op zijn beurt weer kan worden verwerkt tot elementair zwavel of tot gips.
Katalytische reforming
Met behulp van een platinakatalysator worden ketens vertakt of tot cyclische koolwaterstoffen omgezet.
Kraken
Meestal omzetting van zware naar lichtere fracties.
Kraken van zwaardere fracties levert naast lichtere fracties ook gas op. Dit gas is commercieel van minder belang. Daarom worden deze gasvormige koolwaterstoffen gebruikt om benzine te produceren.
Polymerisatie en alkylatie
Polymerisatie
Onder invloed van een katalysator worden twee of meerdere olefinemoleculen aan elkaar gekoppeld. Het verkregen reactieproduct bestaat uit een mengsel van isomeren die slechts 1 dubbele binding bevatten. Ze hebben doorgaans een hoger octaangetal dan paraffinehomologen.
Alkylatie
Alkylatie is een reactie tussen olefinen en isobutaan tot vorming van sterk vertakte alkanen. De bedoeling is de productie van benzine met een hoog octaangetal uitgaande van laagmoleculaire alkenen en isobutaan.
De Petrochemie
zie weer veel informatie hierover op: wikipedia
Petrochemie houdt zich bezig met de verwerking van aardolie en de producten daaruit, verkregen via kraken en destilleren. De eerste commerciële toepassing van een product uit de petrochemie was in 1920 isopropylalcohol, dat voor cosmetica gebruikt wordt. Belangrijke petrochemische bedrijven zijn bijvoorbeeld Shell Chemie met onder meer een vestiging in Moerdijk, ExxonMobil Chemical, met vestigingen in Rotterdam en Antwerpen. DSM ontplooide petrochemische activiteiten van 1970-2002.
Aromaten
Sommige aardoliesoorten, zoals de Borneo-olie die door de BPM werd gewonnen, waren rijk aan aromatische verbindingen. Zulke verbindingen speelden al een belangrijke rol in de steenkoolteerchemie. Er konden onder meer kleurstoffen, medicijnen, bestrijdingsmiddelen en springstoffen mee worden vervaardigd.
Omdat nu ook aardolie de grondstoffen hiervoor leverde, trachtte men op aardoliebasis de steenkoolteerchemie na te bootsen. In 1908 werd in Pernis de 'benzine-inrichting' in werking gesteld. Hier werd de in Balikpapan geproduceerde benzine verder gedestilleerd, waarbij ook een fractie ontstond die 60% tolueen bevatte en toluolbenzine werd genoemd.
In Reisholz bij Düsseldorf werd een fabriek gebouwd, waarbij met behulp van zwavelzuur en salpeterzuur een nitratieproces werd uitgevoerd, dat mononitrotolueen opleverde. Dit was een belangrijke grondstof voor de Duitse kleurstoffenindustrie.
De Eerste Wereldoorlog leidde tot een grote vraag naar springstoffen, zoals TNT, voor de fabricage waarvan tolueen vereist is. Ook in de Verenigde Staten werd, in de raffinaderij te San Francisco van Standard Oil, tolueen gewonnen voor de TNT-fabricage. Toen na de Eerste Wereldoorlog de behoefte aan aromatische stoffen weer het vooroorlogse niveau bereikte, kon de steenkoolteerchemie weer geheel aan de vraag voldoen.
Een aromatische verbinding of aromaat is in de scheikunde een organische verbinding die voldoet aan de regel van Hückel. Die zegt dat een verbinding aromatisch is als die boven en onder het molecuul een cyclische wolk van gedelokaliseerde p-elektronen (elektronen in een p-orbitaal) heeft en het aantal gedelokaliseerde p-elektronen 4n + 2 is. (n = 0, 1, 2, ... ). Een belangrijk kenmerk van aromatische verbindingen is het feit dat alle atomen in één plat vlak liggen.
enkele heteroaromaten:
Wanneer tussen twee atomen niet twee, maar vier elektronen worden gedeeld en zo zorgen voor de chemische binding (een zogenaamde dubbele binding of pi-binding), bevinden zich twee van die elektronen tussen de atomen, en twee andere in een vlak naast de binding. Deze laatste twee worden p-elektronen genoemd. Deze p-elektronen bevinden zich niet alleen tussen de atomen die ze binden, maar ook een beetje ernaast. Wanneer twee dubbele bindingen in een structuur gescheiden zijn door één enkele binding liggen de p-elektronen van de twee dubbele bindingen in hetzelfde vlak, en kunnen de p-elektronen van de ene dubbele binding naar de andere komen. Zulke systemen worden geconjugeerd genoemd, en de elektronen die door het molecuul kunnen bewegen noemt men gedelokaliseerd. Wanneer in een geconjugeerd systeem 4n+2 elektronen zitten (2, 6, 10, 14 of ...) en deze elektronen in ringen gedelokaliseerd zijn, dan levert dit een heel grote extra stabiliteit aan het molecuul. Een molecuul met zo'n systeem wordt aromatisch genoemd.
De eenvoudigste aromatische verbinding is benzeen. Naftaleen bestaat uit twee zesringen met 10 elektronen, daarop volgen met drie zesringen antraceen en fenantreen. Pyreen is een voorbeeld van een aromatisch molecuul met vier zesringen en 18 p-elektronen.
Aromatische verbindingen met een groot aantal ringen worden polycyclische aromatische koolwaterstoffen of PAK's genoemd. Deze verbindingen zijn veelal carcinogeen, omdat ze kunnen intercaleren in het DNA.
Heterocyclische aromaten
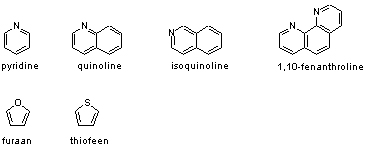
In een aromatisch systeem zijn veel van de atomen koolstofatomen, maar dat is niet noodzakelijk. Ook andere atoomtypen als bijvoorbeeld zuurstof of stikstof kunnen aan een aromatisch systeem bijdragen. Vaak is het zo dat zulke heteroatomen meer dan één elektron of juist geen enkel elektron aan het aromatische systeem bijdragen. Zo kunnen aromatische systemen waar nog steeds 6 elektronen inzitten uit meer of minder dan 6 atomen bestaan. Een aantal eenvoudige voorbeelden zijn pyridine, chinoline, isochinoline en 1,10-fenantroline met stikstofatomen in het aromatische systeem. De stikstofatomen dragen 1 elektron bij aan het aromatische systeem. Voorbeelden met een zuurstof- en zwavelatoom zijn furaan en thiofeen. Bij deze laatste twee verbindingen dragen de heteroatomen twee elektronen bij aan het p-systeem.
Bij heteroatomen uit de tweede en hogere periode wordt de aromatische stabiliteit minder door de naast koolstof minder gunstige elektronenbanen in deze atomen.
Voorbeelden van heteroaromaten
Aromatische ionen
Ook is het mogelijk dat door de extra stabiliteit die wordt gewonnen als er 2, 6 of 10 elektronen in een aromatisch systeem zitten, er uit een geconjugeerd systeem van 3, 7 of 11 elektronen een elektron wordt uitgestoten of in een systeem van 5 of 9 elektronen een extra elektron wordt ingevangen. Een voorbeeld hiervan met 2 elektronen is het cyclopropenyl-kation. Voorbeelden met 6 elektronen zijn het cyclopentadienylanion (extra elektron naast 5 'eigen'): C5H5-, en tropylium-kation (één elektron minder): C7H7+. Azuleen is een isomeer van naftaleen. In plaats van twee zesringen beschikt het molecuul over een vijfring en een ring van 7 koolstofatomen. De vijfring heeft een negatieve lading, de andere ring een positieve.
Alifaten
Bij het kraken ontstonden nevenproducten, waaronder gassen en nafta. Deze producten leverden stoffen als ethyleen, propyleen, buteen en dergelijke. Voorheen werden deze stoffen langs een moeizame weg gevormd, onder meer uit acetyleen, een product dat uit carbid werd verkregen. Vanuit aardoliefracties was de bereiding van ethyleen (etheen), (ethyl)alcohol (ethanol), isopropylalcohol (propanol-2) en aceton (propanon) veel eenvoudiger.
Het belang van ethyleen bleek in 1933, toen bij de Britse firma ICI voor het eerst, onder hoge temperatuur en druk, polyethyleen werd gevormd en de opmars van de plastics (thermoplastische polymeren) begon. In de jaren 60 kwamen de plastics sterk op, waardoor de petrochemische industrie een grote vlucht nam. De ontwikkeling van de kunststoffen, zoals plastics, valt buiten het bereik van de petrochemie, die daartoe slechts de grondstoffen, in de vorm van bepaalde monomeren, levert.
Uit aardolie verkregen butyl werd sinds 1930 toegepast in rubberproducten. Het bleek mogelijk om allerlei tussenproducten, zoals 1,3-butadieen, veel eenvoudiger uit raffinaderijproducten te vervaardigen dan voordien mogelijk was.
Na de Tweede Wereldoorlog nam niet enkel de consumptie van aardolie als brandstof toe. Naast het reeds genoemde synthetische rubber werden ook bijvoorbeeld synthetische wasmiddelen, bestrijdingsmiddelen, medicijnen en kunstvezels in steeds grotere hoeveelheden vervaardigd uit grondstoffen die verkregen worden uit aardolie.
 CO2(g)
CO2(g)
CO2(g)

2CO(g)

2CO(g)
3 CO2(g) + 2Fe(l) (Reductie van ijzeroxide tot ijzer)

Fe (eerst in het vloeibare, later gestolde ijzer)

 ~ C - C - C - C ~
~ C - C - C - C ~


 C6H4(CO2CH2CH2OH)2 + 2CH3OH
C6H4(CO2CH2CH2OH)2 + 2CH3OH
 [(CO)C6H4(CO2CH2CH2O)]n + nHOCH2CH2OH
[(CO)C6H4(CO2CH2CH2O)]n + nHOCH2CH2OH
 [(CO)C6H4(CO2CH2CH2O)]n + 2nH2O
[(CO)C6H4(CO2CH2CH2O)]n + 2nH2O








