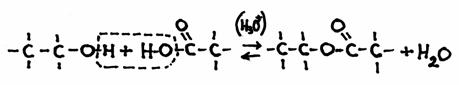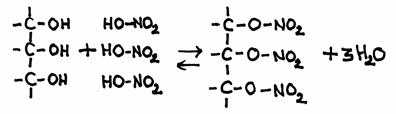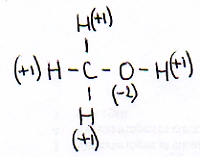KOOLSTOFCHEMIE
Inleiding
Eerst een opmerking over de begrippen: 'koolstofchemie' en 'organische scheikunde'.
Ze bedoelen allebei dezelfde tak van sport, dezelfde onderwerpen van de scheikunde, maar de ene naam moet de andere eigenlijk vervangen.
In het verleden had je organische en anorganische scheikunde. De gedachte was dat de reacties die plaats vinden in dode stof, zoals metalen en steen, principieel anders zijn dan reacties in levende organismen. Zo was alcohol een verbinding die door levende organismen (bacteriën) gemaakt werd, dus een 'organische stof'.
Toen gebeurde het dat men in het laboratorium uit anorganische (dode) materie, een stof kon maken die wel heel erg leek op alcohol, precies dezelfde eigenschappen had. Was er dan dode en levende alcohol? Hoe moest men hiermee omgaan?
Om kort te gaan, na veel geharrewar werd de conclusie getrokken dat het onderscheid tussen dode en levende materie oneigenlijk was, onjuist zelfs. De alcohol die bij gisting wordt gemaakt bleek precies gelijk aan synthetische alcohol.
Wat wel bleek was dat al die organische verbindingen altijd koolstof als hoofdbestanddeel hadden, dat het element koolstof wel heel aparte eigenschappen had waardoor er haast een oneindig aantal koolstofverbindingen bleek te bestaan. Dus waarom niet die oude naam veranderd in 'koolstofchemie"?
En zo is het gekomen. (zie ook andere info van internet
ps: dit wil helemaal niet zeggen dat de naam 'organische chemie' verdwenen is. Helemaal niet! die naam wordt nog steeds heel vaak gebruikt.
Voordat je met de reacties in de koolstofchemie begint doe je er goed aan eerst terug te kijken bij module 4:
de Nomenclatuur van de koolstofchemie.
Module 4 is noodzakelijke voorkennis voor deze module over de koolstofchemie.
En daarna ga je je verdiepen in de reacties van al die moleculen uit de koolstofchemie.
Dat zijn er zoveel dat we ze keurig moeten indelen.
Je kunt ook op internet veel vinden over koolstofchemie
Een heel aardige powerpointpresentatie over koolstofchemie vind je hier
Inhoud van de module
1. Reacties in de koolstofchemie
1.1 Uiterlijk en structuur van organische stoffen
1.2 Het C-atoom en de organische reacties
1.3 Reactiemechanisme
2. Additie & eliminatie
2.1 Additie
2.2 Eliminatie
2.3 Vetharding; boter en margarine
2.4 Poly-additie
3. Substitutie
4. Hidrolyse & Condensatie
4.1 Polycondensatie
4.2 Verzeping
5. Redoxreacties in de koolstofchemie
5.1 Oxidatie van de verschillende organische groepen
5.2 De oxidatoren Cu2+ en Ag+
6. Zuur-base reacties in de koolstofchemie
6.1 Fenol als zuur
6.2 Amfolyt en aminozuur
Er zijn een aantal kenmerkende verschillen tussen organische en anorganische reacties:
organische reacties, in het algemeen,
- verlopen langzaam. De reactiviteit van veel organische stoffen is lager dan die van veel anorganische stoffen.
- verlopen heel vaak niet in watermilieu.
- produceren vaak niet alleen een eindproduct, maar ook bijproducten (die het hoofdproduct lelijk kunnen vervuilen)
gekoppeld aan die laatste twee opmerkingen mogen we ook zeggen dat meestal de organische reacties niet zo'n hoog rendement hebben.
Opdracht 1
Waarom denk je dat organische reacties vaak niet in watermilieu verlopen?
Nadat een reactie in de koolstofchemie is verlopen en het product is gevormd, moet vaak het product worden gezuiverd en dat gebeurt vaak via gefractioneerde destillatie.
Opdracht 2
Stel je een productmengsel voor van 1-hexanol en 1-oktanol.
Leg uit waarom en hoe dit mengsel via gefractioneerde destillatie kan worden gescheiden in de componenten.
De belangrijkste grondstoffen voor de chemische industrie van organische producten zijn Steenkool, Aardolie en Aardgas.
Opdracht 3
Leg uit, met wat kennis van de aardrijkskunde, waarom deze grondstoffen geen van allen het element zuurstof bevatten.
De belangrijkste onderdelen/componenten van aardolie zijn koolwaterstoffen met betrekkelijk lange ketens (de kwaliteit van de aardolie hangt hiermee samen).
De diverse koolwaterstoffen kunnen gescheiden worden door middel van destillatie, maar daarbij doet zich een probleem voor:
De meeste moleculen zijn erg groot en daarom blijft een te groot deel achter als teer en asfalt en krijgen we te weinig nuttige producten.
Kijk maar naar het verkeer: je hebt natuurlijk veel asfalt nodig, maar nog veel meer benzine en diesel (met veel kleinere moleculen) om erop te rijden.
Om nu de opbrengst aan kleinere moleculen te vergroten is er de methode van het
"kraken":
Sterke verhitting van de aardolie (geen zuurstof er bij alsjeblieft!) kan die grote moleculen in kleinere breken.
We hebben het nu over de hoofdprocessen (kraken en vervolgens destilleren) van de zogenaamde olieraffinaderijen.
Met name het kraakproces heeft goede katalysatoren nodig.
Opdracht 4
Leg uit wat "thermokatalyse" betekent.
Antwoord 11-04
De producten van de olieraffinaderij, die kleinere moleculen dus, zijn op hun beurt weer de grondstoffen voor de chemische industrie en vaak opgebouwd uit de elementen waterstof en koolstof: de Koolwaterstoffen.
Misschien zou je ze ook "koolstofhydriden" mogen noemen.
Ze zijn de grondstoffen voor de vele derivaten die de chemische industrie maakt voor toepassingen in de maatschappij, zoals benzine, plastic, nylon, enzovoort.
De bekende alkanen zijn methaan, propaan, butaan. Ze hebben geen grote reactiviteit. Ze branden wel goed, ze ondergaan gemakkelijk substititie. Ze zijn verzadigd, dus additie gaat niet. Zie een volgend hoofdstuk voor de begrippen substitutie en additie.
Additie is wel mogelijk bij alkenen en alkynen. Daarbij worden dubbele of drievoudige bindingen verbroken.
Een zeer bijzondere koolwaterstof is Benzeen en de derivaten daarvan.
We zullen het ook hebben over de opvallend lage reactiviteit van benzeen.
Bij een studie over de stoffen van de koolstofchemie moeten we onderscheid maken tussen de koolwaterstoffen, stoffen met zuurstof en stoffen met stikstof. Ook zijn er verbindingen die al deze elementen bevatten.
[kijk vooral nog eens bij module 4, en wel het stuk over het koolstofatoom]
Over het uiterlijk van organische stoffen mogen we in het algemeen zeggen dat hun uiterlijk direct te maken heeft met:
- het aantal C-atomen per molecuul
- de aanwezigheid van onverzadigde bindingen
- het karakter van substituenten / bijzondere of functionele groepen
- moleculen met lange ketens zijn zwaarder en zullen eerder vaste stoffen zijn
- moleculen met kortere ketens zullen eerder vloeibaar of gas zijn
- de organische stoffen kunnen minder of meer onverzadigde bindingen bevatten (dubbel of drievoudig) en de algemene regel is: hoe verzadigder de stof, des te vaster de stof
Met andere woorden:
Onverzadigde verbindingen zullen eerder olie-achtig zijn (meer vloeibaar) terwijl verzadigde stoffen vetter zijn (vaster).
De moleculen worden minder rigide als het aantal dubbele of drievoudige bindingen toeneemt en daarmee het relatieve aantal H-atomen afneemt.
Vet is dus verzadigder dan olie.
Maar tegelijkertijd mag je niet vergeten dat het eventuele polaire karakter van een stof ook veel invloed heeft: hoe polairder, hoe minder vluchtig.
Opdracht 5
Ethaan is een gas, maar zodra je een H-atoom vervangt door een OH-groep (dan heb je ethanol = alcolhol) wordt de stof vloeibaar.
Leg dit verschijnsel uit.
Meer informatie over dit onderwerp vind je in module 4
Let op: het karakter van een molecuul bepaalt ook hoe zo'n molecuul aan een reactie meedoet.
Bekijk goed de volgende opmerkingen:
Om meerdere redenen is het Koolstofatoom heel speciaal:
- Elk koolstofatoom kan vier bindingen aangaan, wat veel is in vergelijking met andere atomen.
- Het koolstofatoom verbindt zich gemakkelijk met andere koolstofatomen. Silicium doet dat ook min of meer, maar verder 'houden atomen daar niet van'. Meestal koppelen atomen liever aan atomen van een ander type. Er is een voorkeur voor het koppelen van verschillende elementen. Behalve bij Koolstof dus.
Daar komt nog eens bij dat de vier bindingen verschillend van karakter kunnen zijn: enkelvoudig, dubbel of drievoudig. Zelfs kunnen ze nog alifatisch of aromatisch zijn (zie verderop).
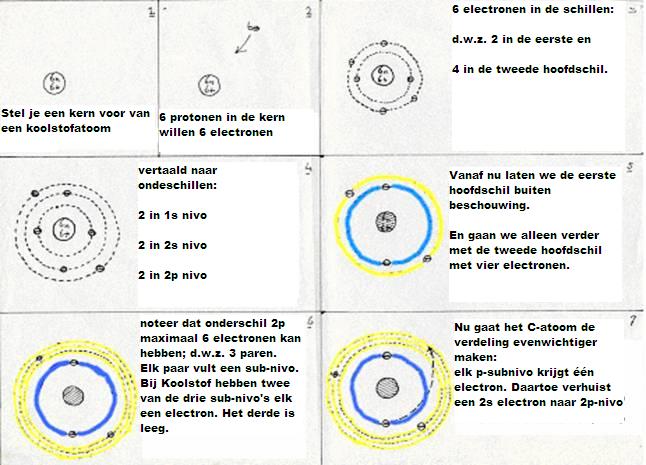
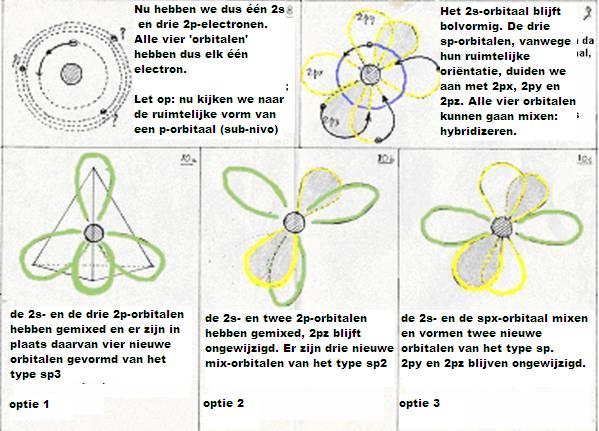
Om dat allemaal te begrijpen is het nodig je te verdiepen in de "orbitalen" van het koolstofatoom. Daarvan zijn er twee van belang voor het aangaan van bindingen: de onderschillen 2s en 2p.
Deze orbitalen kunnen op meerdere manieren samenwerken (bij het vormen van bindingen), o.a. kunnen ze zich met elkaar mengen en "hibriden" vormen:sp3, sp2, sp.
Hieronder een poging om dit duidelijker te maken:
De subniveau's van koolstof zijn: 1s2 2s2 2p2
De eerste hoofdschil 1s2 ondergaat geen enkele verandering, wat het koolstofatoom ook doet, maar in de tweede hoofdschil vindt een soort reorganisatie plaats:
De vier valentie-elektronen (twee s en twee p) hebben een manier gevonden om tot een stabielere situatie te geraken:
- eerst: een elektron 2s wordt een elektron 2p (gaat dus wat verder van de kern af, en dat kost energie).
De nieuwe configuratie is dus: 1s2 2s1 2p3
- daarna: de vier niveau's in hoofdschil 2 gaan nu mixen en hybrides vormen.
Ofwel: Eén 2s-orbitaal en drie 2p-orbitalen doen mee aan die hybridizatie.
Ze vormen vier nieuwe orbitalen van het type sp3 (hierbij komt energie vrij = exotherm heet dat).
Deze vier nieuwe en aan elkaar gelijke orbitalen zijn verantwoordelijk voor de vier (gelijkwaardige en enkelvoudige) bindingen van een koolstofatoom.
Naast deze sp3-hybridisatie bestaan er nog twee andere mogelijkheden:
- De eerste (even herhalen van hierboven) is dus het hybridiseren van een 2s-orbitaal met drie 2p-orobitalen tot vier nieuwe orbitalen van het type sp3
- De tweede mogelijkheid is dat één 2s- en niet drie, maar twee 2p-obitalen meedoen aan de hybridisatie.
Dan vormen zich drie nieuwe orbitalen van het type sp2
en er blijft één oude 2p-orbitaal over; die kan zorgen voor een extra binding.
(dubbele binding: 1 binding is dan van het type σ en één binding is dan π).
- De derde mogelijkheid is dat één 2s-orbitaal en slechts één 2p-orbitaal meedoen aan de hybridisatie.
Dan vormen zich twee nieuwe orbitalen van het type sp en blijven er twee oude 2p-orbitalen over;
zo kan een drievoudige binding ontstaan tussen twee C-atomen (één binding σ en twee bindingen π).
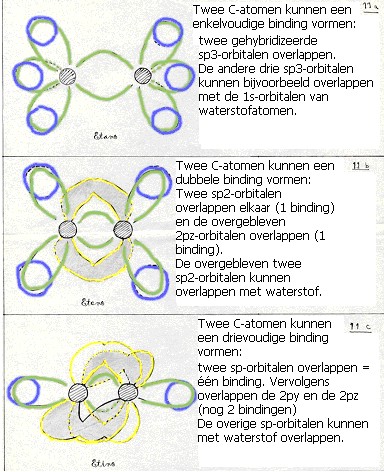
Normaal gesproken blijft het aantal bindingen per C-atoom 4 (bindingen van het type σ, deze zijn alifatisch).
In benzeen en vergelijkbare stoffen heeft elk C-atoom drie orbitalen van het type sp2, die dus per C-atoom drie σ-bindingen vormt. Dan zijn er per C-atoom (dus in een benzeenring 6 in totaal) 2p-orbitalen, die elkaar zodanig overlappen dat ze het molecuul stabiliseren met deze zeer speciale 'vierde' binding van het type π (aromatisch).
Kijk ook even bij wikipedia: pi-bindingen en
sigma-bindingen
Dus:
In het algemeen maakt het koolstofatoom vier sigma (σ)verbindingen met vier andere atomen, ook met C-atomen.
Zo'n regelmatig C-atoom mogen we beschouwen als een atoom met vier gelijke (sp3) bindingen van het type σ.
Dit atoom heeft dan vier van deze (enkelvoudige) bindingen: overlappingen met andere orbitalen, bijvoorbeeld die van waterstofatomen.
N.B over substitutie:
Substitutieprocessen maken dit type bindingen niet kapot. Ze blijven gewoon sp3 met elektronen van het type σ.
N.B. over dubbele en drievoudige bindingen (opties 2 en 3):
Bij koolstofatomen met sp2 of sp hibridizatie hebben we onverzadigde bindingen van het type σ en π.
De π-bindingen kunnen additie ondergaan. Gedurende dit additieproces vermindert het aantal elektronen van het type π ten gunste van elektronen van het type σ.
Opdracht 6
Zoek in de chemische leerboeken op wat er gezegd wordt over de "chemische binding" tussen tussen koolstofatomen onderling.
Een chemische reactie heeft altijd te maken met "herverdeling van valentie-elektronen op het moment dat bepaalde deeltjes in contact treden met elkaar met voldoende energie.
In dit proces verdwijnen chemische bindingen en worden nieuwe gemaakt. Dat weten we al van module 7.
De reactie is het resultaat van een comlex proces, meestal bestaande uit diverse stappen.
Er zal altijd een eerste stap zijn (initiatie), de volgende stappen(continuatie) en zoiets als een terminatie, dus de eindstappen die de reactie beëindigen.
Al die stappen tezamen noemen we ook wel: het reactiemechanisme. [zie ook wikipedia]
In zo'n mechanisme is altijd zoiets als een "aanval" van bepaalde deeltjes op andere deeltjes. De aanvallende deeltjes hebben normaal gesproken voldoende energie daarvoor (anders lukt de aanval niet); ze zijn energie-rijk.
Daarnaast hebben katalysatoren een belangrijke invloed op het mechanisme. Ze doen wel mee, maar komen onveranderd tevoorschijn uit de reactie.
Katalysatoren stimuleren bepaalde stappen van het mechanisme.
In de biochemie spreken we van bio-katalysatoren of enzymen.
In plaats van met een katalysator kan een chemisch proces ook opgestart worden door bijvoorbeeld lichtstraling, die een binding onstabiel maakt en daarmee een deeltje veel reactiever.
Er vormen zich dan geactiveerde deeltjes (met voldoende energie) die de reactie continueren en uiteindelijk ook stoppen.
In de koolstofchemie kennen we twee types reactiemechanismen:
- Er kan een aanval plaats vinden van een positief op een negatief geladen deeltje (elektrofyle aanval) of omgekeerd: een aanval van een negatief op een positief deeltje (nucleofyle aanval).
- Het ander mechanisme is dat van 'radikalen', d.w.z. ongeladen deeltjes die zeer reactief zijn door hun ongepaarde elektron; ladingen spelen hierbij verder geen rol.
In de hiernavolgende hoofdstukken zullen we een aantal reactietypen bespreken die we in de koolstofchemie veelvuldig tegenkomen, zoals additie, condensatie, redox en zuurbase.
In het woord 'additie' zit het begrip opgesloten van 'toevoeging'. Er wordt iets toegevoegd aan een molecuul
In het woord 'eliminatie' zit een ander begrip: 'wegwerken'. Er wordt iets verloren door een molecuul
Additie en eliminatie zijn elkaars tegengestelde in de chemie.
In een koolstofketen kun je dubbele of drievoudige bindingen hebben tussen de C-atomen. In dat geval wordt de stof "onverzadigd" genoemd, d.w.z. die dubbele bindingen kunnen opengaan en aan weerskanten atomen opnemen.
Zo'n binding gaat dan open (op een of andere manier) en de C-atomen aan beide kanten krijgen een open plek, een ongepaard elektron. Een ander atoom dat daarvoor geschikt is, kan dan die opengevallen plaats innemen.
Let wel, we hebben het niet over substitutie waarbij een atoom wordt vervangen, maar over additie waarbij een nieuwe binding wordt gemaakt met zo'n C-atoom.
Stel je het maar als volgt voor: twee mensen houden elkaars handen vast. Ze laten één hand los en pakken de hand van iemand anders.
Opdracht 7
Als je modellen hebt, probeer dan een reactie van dit type te demonstreren met die modellen, bijvoorbeeld etheen met chloor.
Onderzoek dan ook of de binding tussen de C-atomen hun rotatieflexibiliteit behouden.
Heb je geen atoommodellen, probeer dan toch die tweede vraag te beantwoorden.
Additie is dus de reactie van een onverzadigde stof die zich verzadigd met nieuw aangekoppelde atomen of atoomgroepen.
We kunnen het verschijnsel additie ook benaderen vanuit de zogenaamde π en σ-bindingen.
Die bestaan in één molecuul als de koolstofketen dubbele of drievoudige bindingen heeft.
Je kunt ook zeggen: er is overlapping van hybride-orbitalen van het type sp2 en/of sp. De beide bindingstypes σ (lineaire overlapping) en π (parallelle overlapping). Alleen de π-bindingen nemen deel aan de additie.
Voorbeeld van een mogelijk mechanisme van additie: Broom en Etheen
Etheen heeft een dubbele binding, dus een plaats met hogere elektronendichtheid (vier elektronen) en dus met hogere concentratie van negatieve lading.
Die negatieve lading wordt met name veroorzaakt door de π-elektronen.
Als een broommolecuul deze binding nadert veroorzaakt dat in het broommolecuul een soort polaire inductie en vormt zich, laten we zeggen, een (additie)brug.
Een ander broomatoom kan deze brug nu van de andere kant benaderen zoals te zien in de tekening.
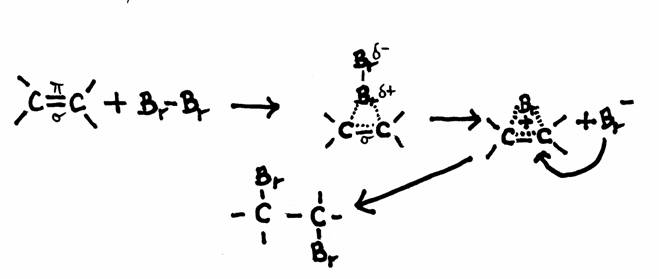
Opdracht 8
Wat kun je waarnemen bij die reactie met broomwater?
Antwoord 11-08
Alkenen kunnen additie ondergaan met diverse stoffen, zoals:
Broom en de overige halogenen; Waterstof; Water; en meer.
Let op: meestal is voor een goede additie een katalysator nodig.
Opdracht 9
Beschrijf alle structuren die betrokken zijn bij de additie van propeen met:
- Water
- Waterstof
- Acetyleengas
Opdracht 10
Calciumcarbide (C2H2) is een witte en vaste stof met een markante geur, zeer onstabiel, die spontaan reageert met water. We noemen het vaak "Carbiet".
De producten bij de reactie van carbide met water: een gas met scherpe geur en een basische oplossing.
Als het gas geleid wordt door Broomwater (een verdunde oplossing van Broom) verdwijnt langzaam de gele kleur van het broomwater.
Leg uit wat er gebeurt
- tijdens de vorming van het gas (met formules)
- tijdens het proces van de ontkleuring, met structuurformules
Antwoord 11-10
Het etheengas (acetyleen) dat bij bovenstaande reactie ontstaat is een zeer energierijke stof.
Vroeger werd die gebruikt in lampen (carbietlantaarns). Tegenwoordig vooral nog bij lassen.
Meer over calciumcarbide vind je op wikipedia.
Opdracht 11
Ethyn is zeer toegankelijk voor additie; in feite kan twee keer additie optreden.
Leg deze bewering uit met structuren en vergelijkingen. Voer de reactie, zo mogelijk, uit met modellen.
Dit is precies het omgekeerde van additie: een molecuul deelt zich in nieuwe moleculen terwijl sommige van die nieuwe moleculen onverzadigd worden, dus dubbele of drievoudige bindingen verkrijgen.
Opdracht 12
Propanol kan uitgangsstof zijn voor propeen in een eliminatie-reactie.
- Geef deze reactie in structuren
- wat voor soort stoffen kunnen bij deze reactie helpen?
Antwoord 11-12
De eliminatie wordt flink toegepast tijdens het kraakproces van aardolie. Er doet zich daarbij flinke groei voor van het aantal (onverzadigde) moleculen.
Boter is een natuurlijk product van de melk. Hier komen we een dierlijk vet tegen.
Als we van de melk het water en de eiwitten afscheiden, houden we de dierlijke vetten over: meestal een tri-ester van glycerol en verzadigde vetzuren.
Voor een deel is boter ook zo'n ester van glycerol, in dit geval met butaanzuur. Dat zuur, een vloeistof, kan vrijkomen en dan ruik je de vieze lucht ervan. Je ruikt het natuurlijk heel erg als de boter ranzig is geworden, dat wil zeggen: als ze begint te ontleden. Bewaar boter maar liever in de koelkast.
Een klein beetje van dit boterzuur komt voor in menselijk zweet.

Leuke details over margarine vind je bij wikipedia.
Melk is ook grondstof voor margarine. Maar die heeft nog een andere grondstof nodig: plantaardige olie (bijvoorbeeld palmolie).
Een probleem is dat margarine dus een mengsel is van olie(l) en melk(l), twee vloeistoffen waarvan de ene (de olie) apolair is en de andere (melk) polair. Eigenlijk levert dat twee problemen op:
- Polair en apolair mengen niet goed en
- Je ziet niet zo gauw iemand vloeibare margarine of boter op zijn brood smeren.
Wat nu gedaan dus?
Vroeger, in de oude margarinefabrieken, loste men het tweede probleem op door minder olie en meer melk te gebruiken en vervolgens het zogenaamde vethardingsproces toe te passen.
Vegetarische olie bevat veel onverzadigde bindingen en dus zijn ze vloeibaar. Men ging dan eenvoudigweg die dubbele bindingen breken en waterstof toevoegen (additie) zodat de olie verzadigder werd. En dus ook harder.
Dat kan met een katalysator (Zn) en onder druk. Het waterstof gaat vastzitten aan de openkomende bindingen van C-atomen.
Maar toen kende men de waarde nog niet van onverzadigde vetzuren voor de gezondheid.
Inmiddels is het voor iedereen duidelijk dat verzadigde vetzuren je aderen kunnen dichtslibben en dat je hoge bloeddruk krijgt of zelfs een hartaanval. Dus wilde men geen vethardingsprocessen meer en de onverzadigde olie juist behouden.
Maar hoe los je dan het probleem op van de vloeibaarheid? Je kunt toch geen vloeibare margarine toepassen?
Welnu, het is mogelijk een polaire en apolaire stof op een speciale manier te mengen: flink roeren en schudden zodat alle onderdelen de vorm krijgen van piepkleine druppeltjes die allemaal netjes door elkaar zitten. We noemen zoiets een "emulsie".
Zo'n emulsie is min of meer vast.
Helaas is zo'n emulsie niet erg stabiel en na enige tijd zie je weer gewoon de twee vloeistoffen boven op elkaar liggen.
Emulgatoren (zie ook wikipedia) lossen dat probleem redelijk goed op: stoffen die zo'n emulsie stabilizeren. Zo kan de emulsie "margarine" verpakt worden in kuipjes en verkocht en bewaard worden.
Additie is mogelijk bij onverzadigde verbindingen, dus bij dubbele of drievoudige bindingen in de koolstofketen. Een normale additie betekent dat zo'n dubbele binding openbreekt waarna de opengevallen plaatsen zich binden aan andere atomen of atoomgroepen.
Maar er bestaat een bijzondere mogelijkheid: dat aan de opengevallen plaatsen zich precies hetzelfde molecuul gaat binden dat zelf ook nog onverzadigde bindingen heeft.
Ze adderen elkaar dus eigenlijk, hun eigen soort. Daarbij is altijd een katalysator nodig.
Er kunnen zich dan plastics vormen die - op hun beurt - geen dubbele bindingen meer bevatten (die zijn opgebruikt bij de poly-additie).
De naam van de monomeer blijft gehandhaafd, maar je zet er gewoon het voorvoegsel "poly" voor.
Bij elkaar dus een complex van reacties, volgens een speciaal reactiemechanisme:
- Op de een of andere manier, waarschijnlijk onder invloed van licht (maar het kan ook een katalysator zijn) vindt er een aanval plaats op de dubbele binding. Die wordt opengebroken en verbindt zich aan één kant aan de katalysator.
De andere kant blijft nog open en staat klaar om zelf weer de aanval voort te zetten op een ander molecuul van hetzelfde type:
Dit is de initiatie (zie ook de initiatie van eenvoudige substitutie):
Cl – Cl  2Cl· (reactief radikaal)
2Cl· (reactief radikaal)
- Tijdens de hoofdreactie of de prorrogatie of continuatie valt het zeer reactieve chlooratoom aan op de dubbele binding:
Cl· + CH2 = CH – CH3  CH2Cl – CH· – CH3
CH2Cl – CH· – CH3
Deze verse radikaal valt aan op de moleculen die in overmaat aanwezig zijn; dat zijn de andere moleculen van propeen:
- C3H6Cl· + C3H6
 C6H12·
C6H12·
- C6H12· + C3H6
 C9H18·
C9H18·
- enzovoort
Het is een kettingreactie die enorm lange ketens veroorzaakt. Elke keer vormt zich een groter radikaal dat elke keer weer opnieuw een monomeer kan vangen. Op die manier ontstaan macromoleculen.
- De hoofdreactie kan gestopt worden als een radikaal (het ongepaarde elektron) een ander radikaal ontmoet, ook met een ongepaard elektron dus.
Die twee elektronen vormen meteen een normale (covalente) binding, de actie is over en de polymerisatie komt ten einde.
Er zijn verschillende manieren om zo'n kettingreactie af te sluiten:
Terminatie: CnH2n· + Cl·
 CnH2nCl
CnH2nCl
of:
CnH2n· + CnH2n·
 C2nH4n
C2nH4n
N.B.
Het voorbeeld gebruikt "radikalen" d.w.z. neutrale deeltjes met een ongepaard elektron.
Zo'n structuur is nogal onstabiel en zo'n ongepaard elektron duiden we aan met een puntje.
Over het algemeen zijn de producten van de poly-additie: plastics in allerlei variaties, afhankelijk van de keuze van de monomeren.
Je kunt je beperken tot één soort monomeren, maar ook is het mogelijk om verschillende monomeren toe te passen in één proces. Dan worden zogenaamde co-polymeren gevormd.
Een voorbeeld is ‘TEFLON’ of TEFAL = poly-tetra fluor etheen, dat de industrie toepast bij de fabrikage van pannen met een tefal-laag.
Dit is een polymeer die slecht absorbeert. In de praktijk zal het eten in zo'n pan niet gauw aanbranden.
Opdracht 13
Geef de structuur van het 'monomeer' van TEFLON (=ptfe).

Een ander voorbeeld is PVC (PolyVinylChloride) = polychloorethaan. Dit wordt in zeer grote hoeveelheden toegepast, bijvoorbeeld bij afvoerbuizen, waterslangen, isoleermateriaal, enzovoort.
In een andere module komen we er nog op terug.
Opdracht 14
Geef de vormingsreactie van PVC, te vormen vanuit zijn monomeer.
De techniek van de polymerisatie
In de fabriek worden polymeren meestal gemaakt in korrelvorm. Vervolgens worden deze korrels behandeld in meer gespecialiseerde industrieën/fabrieken voor de vorming van eindproducten.
Meestal worden dan de korrels verhit waardoor de substantie wat plastischer wordt wat de vormgeving helpt.
Daarin onderscheiden we twee verschillende processen:
- De (macro)moleculen vormen geen onderlinge bindingen, geen vertakkingen. Er onstaat geen driedimensionaal netwerk.
Het product behoudt dan een zekere flexibiliteit. Het materiaal kan gerecycled worden: je kunt het verkorrelen en/of verwarmen en opnieuw in de mallen aanbrengen.
- De moleculen vormen wel een driedimensionaal netwerk doordat ze intermoleculaire bindingen maken. Bijvoorbeeld als er nog dubbele bindingen overgebleven waren.
De producten zullen dan zeer hard zijn, zonder enige flexibiliteit. Recyclen is hier moeilijker.
Alkadiënen en alkatriënen kunnen ook polymerisatie ondergaan met als resultaat een stof met macromoleculen die op hun beurt nog steeds onverzadigd kunnen zijn.
Zo'n onverzadigde polymeer heeft nog eigenschappen van onverzadigde stoffen, oftewel: die zal nog flexibel zijn (vloeibaar kan niet meer bij zulke grote moleculen). Je hebt dan zoiets als rubber.
De elasticiteit van zo'n stof kunnen we verminderen door (partiële) additie. Dat wordt bijvoorbeeld toegepast bij het proces: vulkaniseren van autobanden. Die banden zouden zonder dit proces veel te elastisch zijn en ongeschikt om op te rijden.
Maar bij vulkaniseren worden (een deel van) de dubbele bindingen in het rubber geaddeerd, opgevuld, mogelijk met zuurstofatomen, maar meestal en effectiever met zwavelatomen. Het materiaal behoudt nog voldoende elasticiteit, maar wordt dan een stuk harder.
Een ander bijzonder aspect bij de vorming van polymeren is het mengen van verschillende monomeren waardoor "copolymeren" gevormd worden. De moleculen rijgen zich om en om aan elkaar.
Opdracht 15
Geef de structuur van de co-polymeer die gevormd wordt van de monomeren etheen en propeen.
Macromoleculen van polymeren zijn zo groot dat de stof altijd vast zal zijn. Soms lossen ze min of meer op in water, zoals proteïnen of polysachariden. Dan zie een soort troebeling, ook al is het een oplossing, juist omdat die moleculen zo groot zijn.
De macromoleculen zijn wel opgelost, maar zo groot dat je ze in zeker zin kunt zien.
Tegenwoordig bestaat er een aparte "polymeerchemie" waar men in staat is zeer bijzondere polymeren te maken met minstens zo bijzondere toepassingen.
De twee belangrijkste polymerisatietypes zijn polyadditie en polycondensatie.
Benzeen bevat geen echte dubbele bindingen. De 6 C-atomen van de ring zijn op een andere manier aan elkaar gekoppeld (zie ook module 4).
Additie is daarom niet gemakkelijk hier. De zes bindingen zijn namelijk erg stabiel en laten zich niet maar zo verbreken door een additieproces.
Voor meer info over polymeren kun je ook naar module 15 gaan.
Een H-atoom van een koolstofketen, of een of andere groep aan zo'n keten kan vervangen worden door een ander atoom of atoomgroep. De vervanger noemen we een "substituent".
Voor substitutie aan een alifatische keten heb je licht en warmte nodig.
Voor substitutie aan een aromatische keten/ring heb je een katalysator nodig.
De alkanen kunnen gemakkelijk een substitutieproces ondergaan, waarbij een H wordt vervangen door een ander atoom, bijvoorbeeld een halogeen.
Het proces is tamelijk traag.
Zo zal de substitutie door bijvoorbeeld Chloor (Cl2) langzaam verlopen en alleen met hulp van lichtenergie.
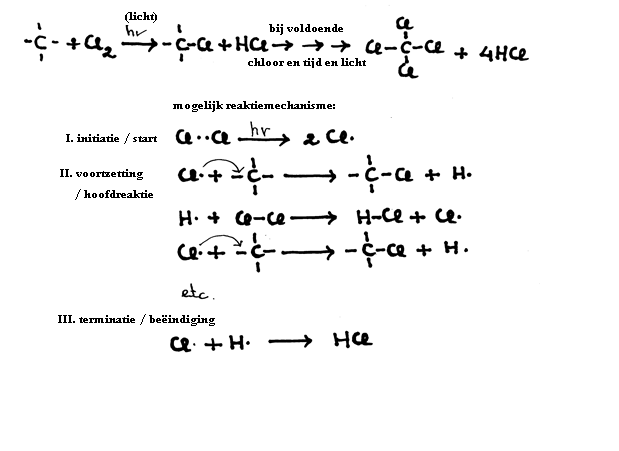
Opdracht 16
- Leg het woord "terminatie" uit; oftewel: waarom gebruiken we hier dit woord?
- Een radikaal met een ongepaard elektron is zeer reactief. Hoe komt dat?
Opdracht 17
Mocht je over modellen beschikken, probeer dan de substitutie van ethaan met chloor na te bootsen.
De nitrilgroep
Een – C≡N groep noemen we "nitril", als de C deel is van een hoofdketen.
Als een – C≡N groep optreedt als een zijketen, dus de C maakt zelf geen deel uit van de hoofdketen, dan kun je de naamgeving Cyanide gebruiken, zoals in de anorganische chemie gewerkt wordt met Cyanide-ionen: -CN-
Nitrilgroepen kunnen worden ingevoerd/gemaakt door een substitutiereactie van cyanide met een halogeenalkaan:
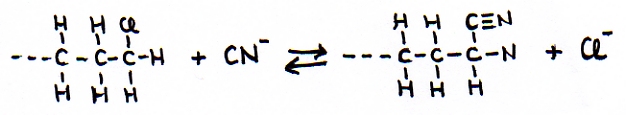
Opdracht 18
Leg uit hoe we deze substitutie mogen beschouwen als een een methode van ketenverlenging.
N.B.
De Nitrilgroep heeft een drievoudige binding. Met als consequentie dat er niet slechts twee, maar zelfs tot drie keer toe kan worden geaddeerd.
Heel bijzonder is dit.
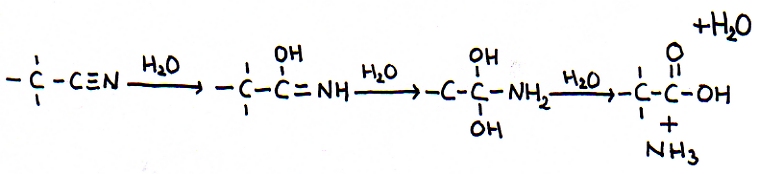
Opdracht 19
Een bijzondere regel is: meer dan één OH-groep gekoppeld aan eenzelfde C in een koolstofketen is niet stabiel; er wordt dan water afgesplitst.
Controleer dat in bovenstaande reactievergelijking.
We voegden eerst drie moleculen water toe t.b.v. de additie, maar aan het eind komt er één molecuul water terug. Ook zie je dat tenslotte een alkaanzuur en ammoniak worden gevormd, de twee eindproducten.
Substitutie met bijproduct H3PO3
Er is een methode om een OH-groep van een keten te substitueren door een halogeenatoom, d.m.v. reactie met 'fosfortrihalogenide'
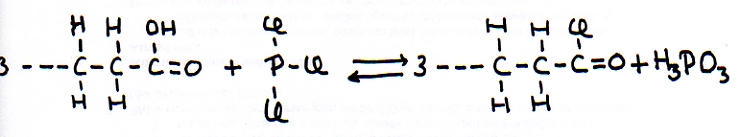
H-atomen van benzeen substitueren gaat gemakkelijk.
De stabiele structuur van de ring verliest zijn stabiele karakter daarbij niet. De 6 C-atomen blijven netjes aan elkaar verbonden, zonder enige verandering.
Er wordt gesubstitueerd aan benzeen met de groepen: nitro, amino, alkyl, sulfon en andere.
Opdracht 20
- Geef in chemische structuren de reactie van de substitutie van chloor aan tolueen.
- Vermeld daarbij ook de reactieomstandigheden.
Antwoord 11-20
Op onderstaande website kun je meer zien over polymeren:
http://wetche.cmbi.ru.nl//vwo/cdrom05/jmol/polymeren/index.html
Condensatie en hydrolyse zijn elkaars tegengestelde, elkaars omgekeerde reactie.
Condensatie: Twee moleculen verbinden zich tot één nieuw molecuul met water als bijproduct.
molecuul 1 + molecuul 2  nieuw molecuul + water
nieuw molecuul + water
Bijvoorbeeld de vorming van een ester:
ethanol + ethaanzuur  ethylethanaat + H2O
ethylethanaat + H2O
(een ouder woord voor ethylethanaat = ethylacetaat)
in structuurformules:
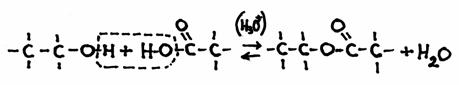
Het is een reversibel proces, dus de directe reactie is de condensatie en de terugreactie wordt hydrolyse genoemd.
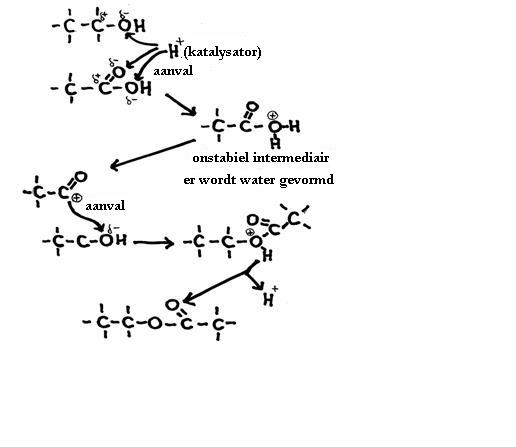
Hydrolyse: Een molecuul reageert met water en vormt dan twee nieuwe moleculen
molecuul + watermolecuul  molecuul 1 + molecuul 2
molecuul 1 + molecuul 2
Bijvoorbeeld de splitsing van een ether in alkanolen.
ethoxi-propaan + water  Ethanol + propanol.
Ethanol + propanol.
Opdracht 25
Laat zien wat zich vormt bij de totale hydrolyse van ethyl-acetaat.
Bovengenoemde reacties kunnen worden versneld met een katalysator. Daarvoor kun je bijvoorbeeld een zuur nemen.
De H+-ionen vallen op een negatieve plek aan en in dat geval noemt men het mechanisme "elektrofyl".
Er zijn andere mechanismen waarin negatieve deeltjes aanvallen op positieve plekken van een of ander molecuul en dan noemen we dat "nucleofyl".
Het komt ook voor dat een alkanol reageert met een niet-organisch zuur. Zo kan bijvoorbeeld glycerol reageren met salpeterzuur.
Normaal reageert glycerol met vetzuren om vetten en oliën te vormen, maar de reactie met salpeterzuur is vergelijkbaar:
Opdracht 21
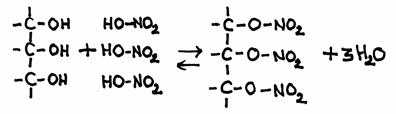
Het product heeft officieel de naam: glycerol-trinitraat. Maar in de praktijk hoor je vaak een andere naam: nitroglycerine
- Geef de reactievergelijking in molecuulformules
- Leg uit dat die naarm 'nitroglycerine' fout is volgens de IUPAC regels.
Antwoord 11-21
Deze reacties bij hydrolyse en condensatie hebben een katalysator nodig (kan een zuur zijn) en ook verhoogde temperatuur.
Veel moleculen verbinden zich aan elkaar waarbij veel watermoleculen als bijproduct ontstaan (of heel soms een ander klein molecuul)
Er wordt een macromolecuul gevormd via een condensatiemechanisme.
voorbeeld:
Glycol C2H4(OH)2, met twee OH-groepen per molecull, kan een polycondensatieproces ondergaan in twee richtingen.
HO – CH2 – CH2 – OH
Elke OH-groep kan reageren met de OH-groep van een ander molecuul. Elke keer wordt dan water gevormd.
Het molecuul van glycol kan zich dus naar twee kanten uitbreiden.
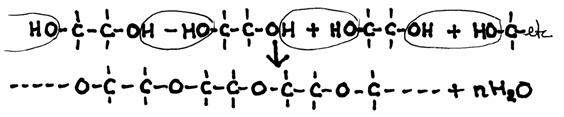
Het product is in dit geval een polyether, een vaste stof, terwijl het reagens, glycol, een vloeistof is.
Opdracht 22
- Probeer deze polycondensatie met modellen na te bootsen
- Leg uit waarom de poly-ether een vast stof zal zijn.
Beroemde polycondensatieproducten:
- Polyethers
- Polyesters
- Polypeptíden
- Polysaccharíden
Copolymerisatie is het proces waarin meer dan slechts één soort monomeren mee doet.
In de industrie zijn en worden veel copolymeren uitgevonden, gemaakt en toegepast.
Zo is bijvoorbeeld het materiaal van videotapes een copolycondensatieproduct van glycol (1,2-dihydroxyethaan) en tereftaalzuur (1.4-dicarboxylbenzeen).
Opdracht 23
Geef een deel van de structuur van deze polymeer.
Opdracht 24
Er kan sprake zijn van copolycondensatie van de monomeren glycol en oxaalzuur, met een klein beetje geconcentreerd zwavelzuur als katalysator.
De reactie begint met een aanval van protonen op oxaalzuur waarbij een carbonium-ion wordt gevormd (een C met een positieve lading). Dit is de langzame stap.
- Probeer het reactiemechanisme te achterhalen, terwijl je weet dat de twee monomeren steeds afwisselend aan elkaar koppelen.
- Leg het feit uit dat de langzaamste stap bepalend is voor de totaalreactiesnelheid.
Verzeping is een proces dat hydrolyse van een vet toepast in basisch milieu.
Daarvoor wordt heel vaak dierlijk vet gebruikt. Het vet ondergaat hydrolyse en dan vormen zich de producten glycerol en vetzuur.
Zo kan men palmolie verzepen en in basisch milieu wordt dan het oliezuur meteen omgezet in natriumpalmitaat (een zout dus). Dat is eigenlijk de zeep.
Indien als base niet NaOH, maar KOH werd gebruikt ontstaat het zout kaliumpalmitaat en zulke kaliumzeep is in de praktijk zachter.
Ook in de koolstofchemie komen redoxreacties voor. Veel koolstofverbindingen zijn in staat om elektronen af te staan of op te nemen.
Let wel: als er hier over oxidatie wordt gesproken, dan wordt niet bedoeld de directe verbranding met zuurstof.
Haast alle stoffen uit de koolstofchemie zijn wel te verbranden tot koolzuurgas en waterdamp, maar daarover gaat het hier niet!
Wel krijg je even een kort een overzicht van directe en indirecte verbranding, maar daarna gaan we naar de bedoelde redoxreacties.
Volledige verbranding
Een mooi voorbeeld van volledige verbranding (maar toch in stappen) zie je in opdracht 39.
Hier krijg je alvast de reactie:
Vrijwel alle koolstofverbindingen (met C en H en andere elementen) reageren sterk met zuurstof.
Het meest reactieve element is dan waterstof dat meteen - in contact met zuurstof - water vormt.
Daarna (d.w.z. het gebeurt vrijwel gelijktijdig) reageert het koolstof en vormt CO2.
Eventueel aanwezig S of N of P of ander elementen kunnen meer producten maken zoals SO2 en de stikstofoxides NxOy. Deze (gasvormige) producten zijn verantwoordelijk voor de luchtvervuiling.
Logisch dat de beste benzine zo weinig mogelijk zwavel en stikstof bevat.
Onvolledige verbranding
Dat vindt plaats als er onvoldoende zuurstof is.
H gaat als eerste natuurlijk weer over in water, maar om het koolstof te verbranden is dan niet genoeg zuurstof voorradig (er kan bijvoorbeeld niet genoeg lucht bij). Dan vormt zich CO (koolmonoxide) of zelfs kan het koolstof onverbrand blijven (roetvorming).
Zorg er voor dat je altijd de stoffen verbrandt bij voldoende luchttoevoer.
Koolmonoxide wordt ook wel kolendamp genoemd, dat herinnert aan de vroegere kolenkachels. Een enkele keer hoor je nog wel eens van een slecht geventileerde badkamer met daarin een geyser.
Oxidatiegetal Nox
In module 10 worden de redoxreacties behandeld, inclusief het oxidatiegetal. Je weet dat bij een redoxreactie de oxidatiegetallen van sommige elementen veranderen.
Bij redoxreacties in de koolstofchemie is dat oxidatiegetal niet altijd gemakkelijk vast te stellen. Waar vindt precies de elektronenoverdracht plaats, dat is de vraag, in het bijzonder ten aanzien van het koolstofatoom/atomen.
De redoxtabellen voorzien niet in halfreacties, dus de veranderingen van het oxidatiegetal zul je zelf moeten uitvogelen.
We nemen methanol als voorbeeld:
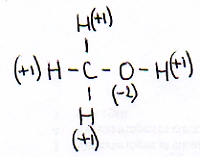
Normaal heeft een H in een verbinding het oxidatiegetal +1 en een O heeft Nox=-2
Deze twee gegevens ken je dus en ook moet je weten dat het hele molecuul neutraal is.
Zo kun je eenvoudig berekenen dat het oxidatiegetal van de C hier -2 moet zijn.
Opdracht 26
Bereken het oxidatiegetal van koolstof in de volgende verbindingen:
- Ethaan
- ethanol
- ethoxi-ethaan
- ethyl-ethan(o)aat
- methaan
Antwoord 11-26
Polariteit in de keten
Een apolaire koolstofketen oxideren is erg moeilijk (we hebben het nu niet over verbranding met zuurstof dus). De verdeling van de valentie-elektronen is hier zeer gelijkmatig, zonder echte verschillen in elektronegativiteit. Het molecuul heeft geen geschikte plekken om aan te vallen.
De aanwezigheid van ladingen δ+ en δ- kan nucleofyle of elektrofyle aanvallen veroorzaken met redoxreacties als gevolg.
Als aan de koolstofketen al een zuurstofatoom vast zit kan die polaire plek gemakkelijk redox ondergaan (elektronenoverdracht).
Het zuurstofatoom, of andere atomen met flinke elektronegativiteit, veroorzaakt de gewenste polariteit in de stof.
Niet alleen is er polariteit nodig, maar ook een plaats waar meer zuurstofatomen (of andere sterk elektronegatieve atomen) zich kunnen aanhechten.
Een vuistregel is dan ook:
Een C kan worden geoxideerd als die C zowel:
een O heeft als een H waar een andere O zich kan plaatsen tussen de C en de H.
Anders gezegd: Om een koolstofverbinding te oxideren is nodig dat er al een zuurstofatoom aan het te oxideren C-atoom vastgekoppeld is en bovendien moet er aan die te oxideren C minstens nog één H-atoom vast zitten.
Normaal wordt dan tijdens de oxidatie een O geplaatst tussen die bedoelde C en H:
H wordt dan dus: OH / Er wordt dus eigenlijk een H vervangen door een OH.
Let op:
Ethermoleculen hebben een O-atoom tussen twee C-atomen in zitten. Daar is sprake van een zekere symmetrie en dus minder polariteit; dan is oxidatie weer een stuk moeilijker.
Een binding tussen twee koolstofatomen is bij gewone oxidatie heel moeilijk te verbreken; koolstofketens blijven meestal ongewijzigd (behalve natuurlijk weer als het een direkte verbranding met zuurstof betreft) waarbij koolzuurgas en water ontstaan.
Opdracht 27
Leg uit of onderstaande stoffen wel of niet te oxideren zijn met aangezuurd dichromaat:
- butaan
- 2-methyl,propanol-2
- aceton
- methoxi-ethaan
Halfreacties koolstofchemie
Enkele verbindingen uit de koolstofchemie vind je in redoxtabel; de meeste echter niet.
Je zult dus in staat moeten zijn om halfreacties zelf op te stellen en te achterhalen hoeveel elektronen er per oxidator of reductor worden overgedragen. Normaal kun je die halfreacties direkt uit de tabel aflezen, maar nu dus even niet.
Opdracht 28
Bij de oxidatie van 1-propanol met aangezuurd permanganaat gaat dit propanol over in propanal.
- Schrijf de elektronenformules op van die twee organische verbindingen en vergelijk het (totaal) aantal valentie-elektronen.
- Schrijf vervolgens de twee halfreacties op in molecuulformules.
Je ziet dat het propanol een elektronenpaar verliest, dus is het een reductor.
Het kloppend maken van zuurstofatomen doe je normaal met watermoleculen; het kloppend maken van H-atomen doe je met ionen H+.
Als deze stoffen vóór de pijl komen te staan, mag dit alleen als water en/of zuur ook werkelijk als hulpstoffen aanwezig zijn.
op internet meer info over halfreacties in de koolstofchemie
Alkanen


Alkanen zijn moeilijk te oxideren, behalve natuurlijk de verbranding met zuurstof. Denk maar aan aardgas, butagas, enzovoort.
Opdracht 29
Volledige verbranding van aardgas neemt veranderingen in de oxidatiegetallen met zich mee.
Laat zien welke veranderingen plaats vinden van oxidatiegetallen.
Alkanolen

Alkanolen worden in het laboratorium meestal geoxideerd met aangezuurd permanganaat of met aangezuurd dichromaat; d.w.z. met een vrij sterke oxidator.
Voor alkanalen zijn zulke sterke oxidatoren niet nodig; zwakkere oxidatoren als Ag+ of Cu2+ zijn voldoende sterk om het doel te bereiken, als tenminste voldaan wordt aan enkele voorwaarden die verderop genoemd worden. Alkanalen worden dus gemakkelijker geoxideerd dan alkanolen.
Als je een alkanol oxideert ontstaat aanvankelijk een stof met twee OH-goepen aan één C-atoom (schets dat of beeld het uit met modellen).
Zoals al gezegd, is zo'n verbinding met meer OH-groepen aan één C niet stabiel; van de twee OH-groepen zal een watermolecuul worden afgesplitst.
Er blijft dan een dubbelgebonden O over. (alkanal, alkanon, alkaanzuur).
Opdracht 30
Leg uit wanneer er op deze manier een alkanal, een alkanol of een alkaanzuur ontstaat.
Je kunt ook alkanolen / alcoholen direct verbranden natuurlijk en je krijgt dan het bekende koolzuurgas en water.
Maar nu hebben we het over de subtielere manier met zwakkere oxidatoren en met bijzondere producten:
Het ion dichromaat in zuur milieu kan een primair alkanol oxideren in twee stappen (via het intermediair alkanal) tot eindproduct alkaanzuur.
Opdracht 31
De volgende stoffen kunnen geoxideerd worden met dichromaat? Ja of nee.
Zoja, wat is het product? En bewijs je antwoord.
- 2-propanol
- Etaandiol (glycol)
Opdracht 32
bewering: "2-methyl 2-propanol kan worden geoxideerd met permanganaat-ionen."
Is deze bewering waar of onwaar? Leg je antwoord uit.
Opdracht 33
Tijdens de oxidatie van 1-propanol met permanganaat(aq), in aanwezigheid van zwavelzuur, verandert het propanol in propanal.
- Geef de elektronenformules van de twee organische stoffen en vergelijk het aantal aanwezige valentie-elektronen.
- Geef ook de twee halfreacties in molecuulformules.
Alkanalen


Voor de oxidatie van alkanalen (gaat vrij goed) gebruiken we vaak ook aangezuurd permanganaat of aangezuurd dichromaat.
Toch zijn deze oxidatoren sterker dan nodig.
Een alkanal bezit een aldehydegroep (-CHO) en de binding C=O is behoorlijk polair waardoor oxidatoren graag aanvallen op het δ+-deel.
Zwakke oxidatoren zoals zilver- en koper(I)-ionen zijn al sterk genoeg om alkanalen te oxideren, waarbij het product een carboxylgroep is, een zuur dus.
Dus: het is gemakkelijker een alkanal te oxideren dan een alkanol.
Opdracht 34
- Wat zal het product zijn bij de oxidatie van ethanal?
- Idem voor de oxidatie van methanal (n.b.: hier hebben we een bijzondere situatie!!)
Alkanonen

Bij de alkanonen is er weliswaar sprake van een aardige polariteit tussen de C en de O van de C=O groep, maar diezelfde C heeft geen extra H-atoom meer, waar een eventuele oxidatie zou moeten plaats vinden.
Het gaat dus niet. Alleen met echt krachtige oxidatoren kan er iets gedaan worden en dan alleen als de C - C-binding wordt stukgemaakt.
Opdracht 35
Beweringen:
- Alkanon bevat een polaire groep
- Alkanon kan niet gemakkelijk worden geoxideerd
Zijn deze beweringen waar? Leg je antwoord uit zonder in de tekst te kijken.
Alkaanzuren
Organische zuren zijn normaal gesproken niet goed te oxideren evenals ethers en esters.
Opdracht 36
Verklaar waarom de die zuren niet goed te oxideren zijn en leg ook uit waarom mierezuur en oxaalzuur hierop een uitzondering zijn.
Opdracht 37
Laat met behulp van elektronenformules zien hoe oxaalzuur(ethaandizuur) als reductor kan optreden.
Opdracht 38
Beweringen:
- Methaanzuur wordt gemakkelijke geoxideerd
- Ethaanzuur wordt gemakkelijk geoxideerd
Zijn die beweringen waar? Leg uit.
Antwoord 11-38
Opdracht 39
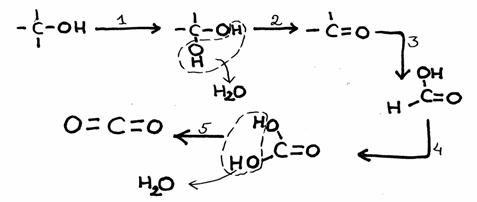
Bestudeer het reactieschema hieronder. Het heeft vijf stappen.
- Van elke stap moet je aangeven of het een redoxreactie is of niet.
Zoja, wat kan de oxidator zijn?

N.B.
- In deze gevallen gaat oxidatie gepaard met de invoering van een O-atoom tussen een C en een H
- meestal is bij organische stoffen de aanwezigheid van meerdere OH-groepen aan één C onstabiel
- de eindproducten zijn kooldioxide en water.
- Probeer deze reactie - als er modellen tot je beschikking staan - na te bootsen.
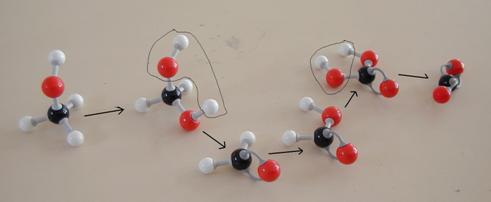
Ethers
Weliswaar zit hier een O tussen twee C-atomen in, dus moet er wat polariteit zijn, maar er is ook grote symmetrie.
We kunnen daarom geen grote polariteit verwachten en het zal daarom moeilijker zijn om ethers te oxideren.
Opdracht 40
Leg de eventuele mogelijkheid uit van oxidatie met aangezuurd dichromaat van:
- Butaan
- 2-methyl propanol-2
- aceton
- methoximethaan
Het is moeilijk organische zuren te oxideren. Niet omdat er geen polariteit zou zijn, maar wel omdat er aan de polaire Cδ+, waar de O zich zou moeten binden, geen H meer zit. Hetzelfde kan gezegd worden voor esters.
Opdracht 41
Methaanzuur en dicarbonzuur kunnen gemakkelijk worden geoxideerd.
- Leg uit waarom deze twee zuren (ook genoemd mierezuur en oxaalzuur) uitzonderingen zijn op de algemene regel.
- In het geval van oxaalzuur, geef de elektronenformules van het reagens en van het product en leg het verschil uit.
Dit zijn tamelijk zwakke oxidatoren. Ze staan in de tabel, maar let op:
Het Cu2+ gaat hier niet over in metallisch Cu als product, maar wel in het ion Cu+.
Het product van de oxidator Ag+ is wel het metaal Ag.
Dus: beide oxidatoren pakken één elektron per ion en ze doen dat alleen in basisch milieu.
Wanneer gebruik gemaakt wordt van de zwakke oxidator Ag+(aq) waaraan een hulpstof is toegevoegd, spreekt men van:
AMMONIAKALE ZILVEROPLOSSING (AZ) of ook wel van TOLLENS REAGENS
Dit reagens is een mengsel van: Zilvernitraat(aq) + ammonia
Wanneer gebruik gemaakt wordt van de zwakke oxidator Cu2+(aq) waaraan enkele hulpstoffen zijn toegevoegd, spreekt men van
FEHLINGS'REAGENS (FR)
FEHLING's Reagens
FR is een mengsel van: koper(II)sulfaat(aq)(soms aangeduid met Fehlings'-A) en een mengsel van Natriumhydroxide(aq) + Na-K-Tartraat (ook wel aangeduid met Fehlings'-B)
De oxidator is hier het ion Cu2+ dat bij reactie het ion Cu+ vormt.
Let wel: dit gegeven vormt de basis van deze reactie.
Maar de reactievoorwaarden zijn een beetje gecompliceerd:
- Deze reactie kan alleen plaats vinden in basisch milieu.
- Bij deze reactie moet verwarmd worden; er is energie nodig.
Eerst hebben we een oplossing nodig van Koper(II)sulfaat, CuSO4(aq), zoals bekend: Fehlings A
T.b.v. het basisch milieu voegen we natriumhydroxide toe, NaOH(aq).
Maar meteen bij dat toevoegen heb je een probleem:
De Cu2+-ionen reageren meteen met OH- tot een neerslag van Koper(II)hydroxide Cu(OH)2.
Dit moet voorkomen worden.
En dat kan ook. Daartoe voegen we een andere stof toe: Na-K-tartraat(aq). Deze stof "pakt de koper-ionen in" zodat ze niet met de hydroxide ionen kunnen reageren.
Het mengsel van de twee oplossingen, NaOH(aq) en Na-K-tartraat(aq) noemen we Fehlings B.
Fehlings'A + B worden pas op het laatste moment vòòr gebruik samengevoegd omdat dit mengsel (FR) niet stabiel is. Je kunt het niet lang bewaren.
Zodra FR is toegevoegd aan het te oxideren mengsel (dus met een organische reductor), moet er verwarmd worden om de benodigde energie te bereiken.
Het behoeft geen sterke reductor te zijn. Een zwakke zoals ethanal(aq) voldoet.
In een reageerbuis met een paar ml ethanal voegen we een paar ml FR toe en we gaan rustig verwarmen boven een klein vlammetje of in een waterbad. Langzaam zien we kleurverandering (groen en geel en rood) en neerslagvorming (rode stof = CuOH(s)).
De Ammoniakale Zilveroplossing
In geval van de oxidator Ag+, is het proces ongeveer gelijk:
- Deze reactie kan alleen plaats vinden in basisch milieu.
- Bij deze reactie moet verwarmd worden; er is energie nodig.
En ook hier moet de neerslagvorming (nu van AgOH) voorkomen worden, waarvoor nu niet tartraat, maar ammoniak(aq) = ammonia wordt gebruikt.
Het is ontzettend belangrijk hier om schone buizen te gebruiken omdat het product zilver alleen zich afzet op vetvrije glazen wanden.
In buis 1 doen we een paar ml zilvernitraatoplossing (AgNO3(aq)).
Aan deze oplossing voegen we toe - beetje bij beetje - de ammonia.
N.B.: ammoniak is op zich al basisch, dus is het niet nodig om ook NaOH toe te voegen.
Even zie je het AgOH neerslaan, maar al gauw verdwijnt het als meer ammonia wordt toegevoegd.
Dan is de AZ klaar voor gebruik als oxidator.
We voegen een paar ml van de oplossing van de reductor samen met een paar ml AZ. De reductor kan weer zoiets zijn als ethanal of methanal (of glucose). Als er maar een aldehydegroep in zit.
Goed mengen en dan zet je de buis voorzichtig enige tijd in een waterbadje. We kunnen dan de vorming van de zilverspiegel zien.
Meer over de funktie van het Tartraat en het Ammonia
Hoe lukt het nu om die ionen Cu2+ of Ag+ oplosbaar te houden in een basische oplossing?
Hoe beschermen de tartraat-ionen de Koperionen tegen de OH--ionen?
Hoe beschermen de ammoniak-moleculen de Zilverionen tegen de OH--ionen?
Hoe doen ze dat?
Ze omringen die ionen, ze schermen ze af.
Opdracht 42
Probeer over die twee reagentia (Fehlings' Reagens en Tollens Reagens) het volgende uit te leggen:
- de evenwichten en de ligging daarvan van de halfreacties
- de invloed van basisch milieu
- de invloed van de temperatuur
- hoe te voorkomen dat er neerslagvorming optreedt
- de waarnemingen die je kunt doen tijdens de reacties.
Opdracht 43
Bij een aantal stoffen moet je nu onderzoeken of ze te oxideren zijn met FR of met AZ. (natuurlijk als je op school of ergens anders spullen kunt gebruiken die nodig zijn)
Probeer de zilverspiegel zo mooi mogelijk te maken.
De te onderzoeken stoffen zijn:
- glucose
- fruktose
- saccharose
- een oplossing van saccharose, nadat die eerst enige tijd is gekookt.
- een zetmeeloplossing, ook nadat die enige tijd is gekookt.
Als je niet in een lab terecht kan, blijft het voorlopig bij een gedachtenexperiment.
Deze zelfde reagentia behandelen we ook nog eens bij module 12, over de biochemie.
Veel informatie over zuur-base reacties is te vinden in module 9. Hier gaat het over de zuur-base reacties in de koolstofchemie.
zuur + base  geconjugeerde base + geconjugeerd zuur
geconjugeerde base + geconjugeerd zuur
Organische zuren splitsen alleen H+ af van de zgn. hydroxigroepen (-OH), meestal binnen de carboxylstructuur.
Organische zuren zijn over het algemeen zwak. Een van de sterkste organische zuren is mierenzuur.
Dat die carboxylgroep zuur is wordt mogelijk gemaakt door het bestaan van sterke polariteit in die groep. Die veroorzaakt een flinke afstoting tussen het C-atoom en het H-atoom die allebei een zekere positieve lading (δ+) hebben.

Opdracht 44
Noteer de structuur van mierenzuur (methaanzuur) en bedenk een reden waarom dit zuur soms gebruikt wordt als toiletreiniger.
Alleen hydroxigroepen kunnen protonen afsplitsen, echter alleen dán als aan dezelfde C van de hydroxigroep nóg een zuurstofatoom is vastgekoppeld of als die hydroxigroep aan een benzeenring vast zit.
Denk erom dat H-atomen die direct aan een koolstofketen vastzitten nooit optreden als af te splitsen H+
Gewone alcoholgroepen kunnen normaal geen H+-ionen afsplitsen, tenzij er zeer agressieve stoffen als Na of K worden toegevoegd.
Opdracht 45
Schrijf namen en structuren op van de stoffen die je krijgt als onderstaande zuren één of meer protonen afsplitsen:
- mierenzuur
- stearinezuur
- fenol
- 1-propanol (in uitzonderlijke gevallen)
Opdracht 46
Oxaalzuur (twee carboxylgroepen direct aan elkaar gekoppeld = H2C2O4) is niet alleen maar een sterker zuur, maar kan ook gemakkelijk in tweeën breken waarbij twee moleculen CO2 gevormd worden.
Leg dit nader uit.
Als de koolstofketen van een organisch zuur vrij lang is, spreekt men van een vetzuur.
Als in die keten bovendien één of meer dubbele bindingen zitten is het een (meervoudig) onverzadigd vetzuur.
Opdracht 47
Zoek een viervoudig onverzadigd vetzuur op in tabellen / scheikundeboeken / internet en noteer daarvan de systematische naam.
Een NH2-groep, gekoppeld aan een koolstofketen is zó opgebouwd dat het N-atoom (min of meer δ-) bezit nog steeds een vrij elektronenpaar, beschikbaar voor het opnemen van deeltjes zonder elektronen, zoals het H+-ion.
Als dat gebeurd is wordt de aminogroep positief: – NH3+.
Opdracht 48
Geef de reactie van een aminogroep, in structuren, als die H+ opneemt van azijnzuur.
Als een organisch molecuul (dus een stof uit de koolstofchemie) zowel een zuurgroep alsook een aminogroep bevat dan heb je een aminozuur.
Die groepen: carboxyl- en amino- reageren niet alleen als zuren of basen, maar ook doen ze mee bij condensatie, bij de vorming van esters of peptiden.
Opdracht 49
Zoek in de tabel met aminozuren een eenvoudig aminozuur op en schrijf de structuren op van dit aminozuur in sterk zuur en in sterk basisch milieu.
In zuur milieu gebracht (bij lage pH-waarden dus), is een aminozuur positief en in basisch milieu (bij hoge pH) is het aminozuur negatief geladen.
Ergens tussen dat hoog en laag moet zich dus een pH-waarde bevinden waarbij de aminozuurmoleculen gemiddeld neutraal zijn.
Deze bijzondere pH-waarde noemt men het iso-elektrisch punt: het I.E.P.
Opdracht 50
In het iso-elektrisch punt kan het aminozuurmolecuul als een zgn dubbelion voorkomen. Leg dit uit.
Sommige ingewikkelde (aromatische) organische zuren hebben dank zij hun structuur een bepaalde kleur, die verandert als er één of meer protonen worden afgesplitst. Deze stoffen zijn geschikt als zuur-base-indikator. (zie ook module 9)
HIn  H+ + In-
H+ + In-
kleur 1 kleur 2
Er is een bijzonder type OH-groep die als zwak zuur kan functioneren. We hebben het dan niet over de gewone alifatische OH-groep, maar over de aromatische OH-groep, die aan een benzeenring vastzit.
Een benzeenring met een OH-groep noemen we "fenol". Je vindt het ook op wikipedia.
| C6H5OH |
+ |
OH- |
 |
C6H5O- |
+ |
H2O |
| zuur |
|
base |
 |
geconjugeerde base |
+ |
geconjugeerd zuur |
In structuren zie je dat fenol op de volgende manier afstaat:
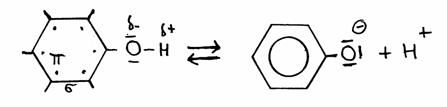
fenol fenolaat
Het bijzondere is dat in fenolaat alle valentie-elektronen van zuurstof, samen met de elektronen van het type π in de ring, in een zgn resonantie-toestand komen.
Het negatieve ion wordt daardoor een stuk stabieler.
De consequentie is dat het fenol daaraan de neiging overhoudt om een H+ af te staan, veel sterker dan een gewone alifatische OH-groep.
Opdracht 51
Leg uit waarom de sterkte van de stoffen te maken heeft met een eventuele reversibiliteit.
De hydroxylgroep en hydroxybenzeen
We weten al dat een OH-groep alleen dán H+ kan verliezen/afstaan (reageren als zuur) als dat C-atoom tegelijk ook verbonden is met een O (dan hebben we het dus over een carboxylgroep).
De alifatische hydroxigroep, dat is een alcoholgroep, treedt normaal gesproken niet op als zuur en ook niet als base.
De normale alcoholgroep is dus niet basisch en niet zuur.
Slechts in het geval we een zeer agressieve, reactieve stof toepassen, zoals het metaal Natrium, kan het gebeuren dat de OH-groep zijn H laat afpakken.
CH3 – CH2 – OH + Na·  CH3 – CH2 – O- + Na+ + H·
CH3 – CH2 – O- + Na+ + H·
Zodra er 2 H·-radikalen bestaan, vormt zich een H2-molecuul en dus een gas.
Het andere product noemt men natriumethanolaat, een sterk basische stof.
In structuren:
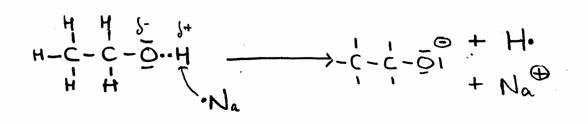
Opdracht 52
- Let goed op wat er in bovenstaande reactie gebeurt met de valentie-elektronen.
- Leg uit waarom CH3 – CH2 – O- (+ Na+ ) een zeer sterk basisch karakter bezit.
(terwijl alcohol vrijwel geen zuur karakter heeft)
De reactie wordt niet als in evenwicht beschouwd.
- Is deze reactie nu zuur-base of redox? Leg uit.
Er zijn organische moleculen die aan hun koolstofketen zowel een carboxylgroep (zuur) hebben alsook een aminogroep (base).
Je hebt al gezien dat dit een aminozuur is. Zo'n aminozuur is dus een amfolyt.
Deze moleculen gaan we behandelen in module 12, de biochemie.
Opracht 53
Een zeer eenvoudig aminozuur is Alanine (2-amino-propaanzuur)
- Geef de structuur en leg uit waar en hoe de amfotere reacties plaats vinden
- Leg uit wat een dubbelion is.
Antwoord 11-53
 2Cl· (reactief radikaal)
2Cl· (reactief radikaal)
 CH2Cl – CH· – CH3
CH2Cl – CH· – CH3
 C6H12·
C6H12·
 C9H18·
C9H18·
 CnH2nCl
CnH2nCl
 C2nH4n
C2nH4n







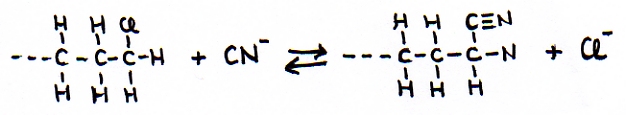
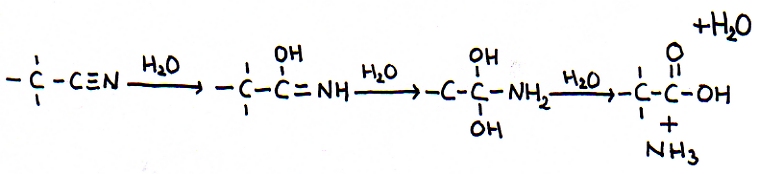
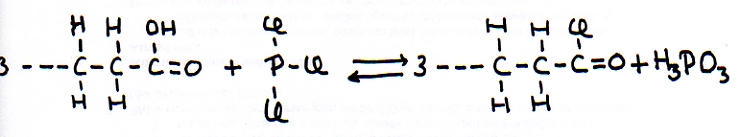
 nieuw molecuul + water
nieuw molecuul + water