STRUCTUUR VAN DE MATERIE
Inleiding
Elk beetje materie - of dat nu vast, vloeibaar of gas is - is een STOF of een mengsel van stoffen.
Nu je, na de modules 01 tot 04, wat afweet van atomen, chemische bindingen en nomenclatuur, kun je de materie en de stoffen gaan bekijken op een meer scheikundige manier.
Een beetje basiskennis van natuurkunde is hier zeker ook nodig.
Je gaat nu je kennis toepassen op de microwereld van atomen, ionen en moleculen, en begrip krijgen van de materie die beschouwd wordt als:
alles wat massa en volume heeft
Inhoud van de module
1. Het deeltjeskarakter van de materie
1.1 MOL; molaire massa
1.2 Volume van gassen
2. Zuivere stoffen en mengsels
2.1 Fases; (s) (l) (g)(en (aq))
2.2 Homogene en heterogene mengsels
2.3 Concentratie en molariteit
2.4 Massa- en Volumepercentage
3. Eigenschappen van zuivere stoffen (stofeigenschappen)
3.1 Roostertypes
3.2 Verandering van fase
3.3 Oplosbaarheid
3.4 Geleidbaarheid
3.5 Hardheid van stoffen
3.6 Kristalwater en hydratatie
4. Scheidingsmethoden
4.1 Extractie van (s) + (s)
4.2 Absorptie van
(l) + (l) of (l) + (s) of (g) + (g)
4.3 Destillatie van (l) + (l)
4.4 Filtratie van (s) + (l)
4.5 Precipitatie van (s) + (l)
4.6 Verdamping van (l) + (s)
4.7 Centrifugatie van (s) + (l)
5. Materie en Energie
5.1 Energie in voedingsstoffen
5.2 Energie en faseverandering
5.3 Fossiele brandstoffen: kolen, olie en aardgas
5.4 Alternatieve brandstoffen: metanol/ethanol; biogas; waterstof
5.5 Batterijen en accu's
Opdracht 1
Wat denk je: is lucht een stof?
Leg je antwoord uit.
Vrijwel alle materie die wij om ons heen kennen, is opgebouwd uit mengsels.
Mengsels kun je scheiden in componenten, de zuivere stoffen.
Die zuivere stoffen zijn op hun beurt weer opgebouwd uit één soort gelijke deeltjes: moleculen of ionen. Zuivere stoffen (als het nog geen elementen zijn) kun je nog ontleden in de elementen.
En een element is opgebouwd uit slechts één soort atomen.
Opdracht 2
Zal lucht een zuivere stof zijn of een mengsel? Leg uit.
Elke stof is opgebouwd uit 'deeltjes': moleculen, macromoleculen of (samengestelde of eenvoudige) ionen. In uitzonderlijke gevallen is een stof alleen maar uit atomen opgebouwd.
Al die deeltjes kunnen variëren in grootte, molecuulmassa, in lading, in (a)polair karakter en in kinetische energie (beweging, trilling).
Opdracht 3
Stel je een stof voor die opgebouwd is uit zeer beweeglijke deeltjes: klein, licht en met weinig aantrekkingskracht.
Zal die stof vast zijn, vloeibaar of gas? Leg je antwoord uit.
Antwoord 05-03
Een stof opwarmen (= warmte-energie toevoeren) betekent dat elk deeltje er kinetische energie (bewegingsenergie) bij krijgt. Het deeltje gaat meer bewegen. Dat kan zijn verplaatsing, maar ook gewoon trilling.
Daar is vrijwel geen grens aan; je kunt altijd nog feller bewegen, d.w.z.: nog heter worden, tot aan miljoenen graden Celcius. De beweging wordt steeds heftiger.
Let wel: er kan wel iets gebeuren met de bindingen in die stof.
Een stof afkoelen heeft wel een limiet. In dit proces neemt de beweging van het deeltje juist af. Tenslotte ligt het deeltje helemaal stil; er is geen beweging meer. Stiller dan bewegingsloos kan niet. Zelfs de lichtste deeltjes, met nauwelijks enige onderlinge aantrekkingskracht, zullen bij voldoende lage temperatuur helemaal stil komen te liggen.
Zij vormen dan eerst een vloeistof (er is nog beweging van de deeltjes) en tenslotte een vaste stof met een onbeweeglijk (molecuul)rooster.
Minder beweging dan géén beweging kan niet  een lagere temperatuur dan de minimumtemperatuur bestaat niet = 0 K (= -273ºC)
een lagere temperatuur dan de minimumtemperatuur bestaat niet = 0 K (= -273ºC)
Je mag dus zeggen dat temperatuur een maat is voor beweging van de deeltjes.
Opdracht 4
Leg uit of de volgende bewering waar is of onwaar:
"Als je geen eenheden gebruikt is de molaire massa gelijk aan de molecuulmassa."
De massa van de materie (haar gewicht, zeg maar voor het gemak) zit voor het allergrootste deel in de kerndeeltjes, de protonen en neutronen. De elektronen wegen vrijwel niets; hun massa mag je op het geheel verwaarlozen.
Dat wil dus ook zeggen dat de massa van een deeltje direct afhangt van het aantal nucleonen in dat deeltje.
Een watermolecuul bevat 2 waterstof- en 1 zuurstofatoom
- elk atoom waterstof bevat 1 proton in de kern
- elk zuurstofatoom bevat 8 protonen en 8 neutronen in de kern
- een watermolecuul bevat dus 2 + 16 = 18 nucleonen (kerndeeltjes)
Vanuit die gedachte is een nieuwe eenheid van massa ingevoerd:
de atomaire massa-eenheid = het gemiddelde gewicht van één kerndeeltje (van één nucleon)
Als dus een deeltje bijvoorbeeld 100 nucleonen bezit, dan zal de (molecuul)massa van dit deeltje 100 a.m.e. zijn.
- een watermolecuul bevat dus 2 + 16 = 18 nucleonen (kerndeeltjes)
 dus de massa van één molecuul water is 18 a.m.e.
dus de massa van één molecuul water is 18 a.m.e.
Een atomaire massa-eenheid is zo'n ongelooflijk piepklein beetje dat geen weegschaal op aarde die wegen kan. Weegschalen werken met grammen, miligrammen, maar niet veel minder dan dat.
Om één gram materie te hebben (weegbaar op een weegschaal dus) heb je bij elkaar 6 x 1023 nucleonen nodig.
Dit aantal noemt men ook wel: het getal van Avogadro), maar meestal spreken we van: 1 MOL
Een MOL in de scheikunde is dus een eenheid van aantal, net als een paar (2), of een dozijn (12) of een gros (144)
Je kunt dus 1 MOL moleculen hebben, 1 MOL ionen, 1 MOL elektronen, 1 MOL protonen, enzovoort.
Een heel andere mol dus dan in de biologie.
Opdracht 5
Denk je dat het totaal aantal mensen op aarde meer of minder zal zijn dan 1 MOL?
Maak een schatting om tot je antwoord te komen.
Antwoord 05-05
Controleer nu het volgende:
'
Eén watermolecuul heeft 18 kerndeeltjes (nucleonen); dus één molecuul water weegt 18 a.m.e.
1 MOL water bevat 6 x 1023 watermoleculen;
1 MOL water bevat dus 6 x 1023 x 18 kerndeeltjes;
6 x 1023 kerndeeltjes hebben een massa van 1 gram → 1 MOL water weegt 18 gram.
Dus:
- de massa van 1 watermolecuul = 18 a.m.e. = molecuulmassa (microniveau)
- de massa van 1 MOL watermoleculen = 18 gram = molaire massa (macroniveau)
molecuulmassa en molaire massa zijn gelijk als je de eenheden er niet bij zet.
Massagetal & atoommassa
Er is iets wat het rekenen met deze begrippen bemoeilijkt: dat is het bestaan van isotopen.
Bijvoorbeeld: van het element Chloor bestaan in de natuur twee types (twee isotopen): chlooratomen met 18 neutronen en chlooratomen met 20 neutronen. Uiteraard heeft elk chlooratoom ook 17 protonen (anders was het geen chloor).
1 MOL van het isotoop 35Cl heeft een massa van 35 g [atoommassa = 35]
1 MOL van het isotoop 37Cl heeft een massa van 37 g [atoommassa = 37]
In de natuur bevindt zich een mengsel van de twee isotopen in de verhouding van (±)3 : 1 en dat betekent dat het element Chloor, zoals dat in onze wereld voorkomt, een gemiddelde atoommassa heeft van ongeveer 35,5
Zoiets geldt voor heel veel elementen. Daarom zal in de praktijk meestal de atoommassa van een element niet precies gelijk zijn aan het massagetal van één isotoop van dat element. In tabellen kom je gemiddelde atoommassa's tegen.
Opdracht 6
Bereken de molecuulmassa van keukenzout.
Opdracht 7
Moleculen kunnen flink verschillen in grootte. Zo heeft water kleine moleculen en eiwitten heel grote (macromoleculen).
Ook amylose is groot; het is een polyglucose, opgebouwd uit vele aan elkaar gekoppelde moleculen van glucose.
Stel nu dat één molecuul amylose 800 monomeren heeft en de formule is C6H10O5)n, bereken dan de molecuulmassa van dit polymeer.
Het valt niet mee om je de grootte van één deeltje van een stof voor te stellen, zo fantastisch klein zijn die deeltjes!
Toch bestaan er (relatief) grote verschillen tussen die deeltjes onderling: zo heb je macromoleculen, zetmeel bijvoorbeeld, die zo groot zijn dat ze het water waarin je ze oplost een beetje troebel maken. De véél kleinere suikermoleculen zullen dat nooit doen. Een suikeroplossing blijft altijd een helder transparant mengsel, wat bij de meeste oplossingen in water het geval is.
Ook al kun je deeltjes meestal niet afzonderlijk zien, in de praktijk kun je stoffen wel zien als de deeltjes dicht genoeg bij elkaar zitten, zelfs als die deeltjes klein zijn.
Je begrijpt wel dat het aantal deeltjes, nodig om een stof zichtbaar te maken, enorm groot moet zijn.
Opdracht 8
"Eén kristalletje suiker kan wel 100.000.000.000.000.000 moleculen C12H22O11 bevatten"
Is deze bewering waar of onwaar?
Onderstaand diagram toont de relatie tussen de eenheden op micro-nivo (atomen e.d.) en op macro-nivo (grammen e.d.) met de eenheid MOL in het centrum:
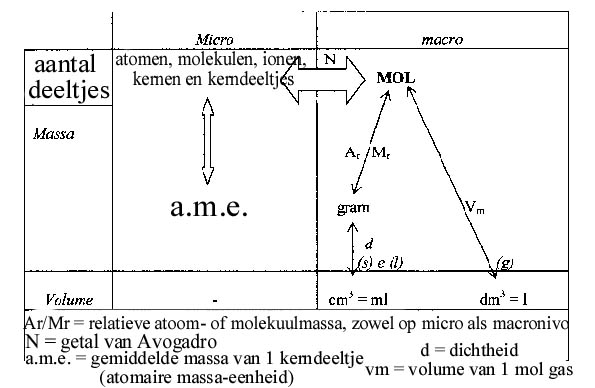
Voorbeeld 1:
Van de stof CuSO4.5H2O wordt 4 gram afgewogen.
Hoeveel MOL gehydrateerd kopersulfaat (lichtblauwe kristallen) is dat? Gebruik tabel V.
Antwoord:
Van gram naar MOL moet je de molecuulmassa gebruiken. Hier: Cu + S + 9O + 10H = 63,5 + 32,1 + 144 + 10 = 249,6
249,6 gram van de stof (gehydrateerd kopersulfaat)= 1 MOL.
 1 gram = 1/249,6 MOL
1 gram = 1/249,6 MOL
 4 gram = 4 x 1/249,6 MOL = 0,016 MOL
4 gram = 4 x 1/249,6 MOL = 0,016 MOL
4 gram CuSO4.5H2O is dus gelijk aan 0,016 MOL CuSO4.5H2O
ofwel: 0,016 MOL CuSO4.5H2O weegt vier gram.
Voorbeeld 2:
Stel dat een glas bier (100 ml=een pijpje) 5 ml alcohol bevat (C2H5OH, dichtheid van alcohol= 0,8g/ml)
hoeveel gram alcohol zit er in een liter bier?
Antwoord:
We kennen het aantal ml, maar gevraagd wordt naar grammen van een vloeistof (alcohol)
dus je begrijpt, we zullen de dichtheid nodig hebben. d = 0,8 d.w.z.: 1 ml alcohol heeft een massa van 0,8 gram.
 5 ml weegt 5 x 0,8 gram (= 4 gram).
5 ml weegt 5 x 0,8 gram (= 4 gram).
Eén glas (=100 ml bier) bevat 5 ml = 4 gr alcohol
 1 liter (=1000 ml) moet dan dus 10 x zoveel bevatten = 40 gram alcohol [dat is al genoeg om heel wat hersencellen in hun groei te remmen!!]
1 liter (=1000 ml) moet dan dus 10 x zoveel bevatten = 40 gram alcohol [dat is al genoeg om heel wat hersencellen in hun groei te remmen!!]
Opdracht 9
Leg aan iemand uit wat elke pijl betekent in het schema over MOL-berekeningen.
Opdracht 10
Waar of onwaar? Leg uit!
- 12 g Koolstof bevat 1 mol atomen
- 28 g Stikstof bevat 1 mol moleculen
Antwoord 05-10
We kijken vooral naar het volume van 1 MOL gas. Dat is namelijk bij gassen bijzonder. (niet bij (s) of (l))
Een willekeurig gas bij de temperatuur van 0oC en een druk van 1 atm. heeft een volume van 22,4 liter per MOL (= molair volume van gassen).
N.B. Elk gas heeft dus eenzelfde molair volume, maar let op: niet dezelfde molaire massa!! De gasdeeltjes kunnen zwaarder of lichter zijn.
Het doet er niet toe over welk gas het gaat, het volume dat het bezet wordt altijd en uitsluitend bepaald door de temperatuur en de druk van dat gas, of dat gas nu grote of kleine moleculen heeft.
We passen dit toe met de volgende formule:
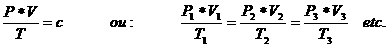
De temperatuur T wordt gegeven in Kelvin!! De druk in Nm2. Het volume in m3
De constante c is: n x R, waarbij:
n = het aantal mol en R = 0,0821 J x mol-1 x K-1
Opdracht 11
Bereken het volume van 10 gram waterstofgas, 10 gram heliumgas en 10 gram butagas; allemaal gemeten bij een temperatuur van 0oC en 1 atm.
Opdracht 12
In de vorige opdracht ligt een probleem: bij 0ºC en 1 atm. is butagas niet meer gasvormig, maar een vloeistof.
- wat zegt dat over het kookpunt van butaan?
- wat kun je zeggen over het berekende volume?
Opdracht 13
Bereken het gasvolume bij 25ºC en 76cm Hg.
Opdracht 14
Noem een paar stoffen die in zuivere vorm voorkomen (dus niet gemengd met iets anders):
- thuis of op straat of in winkels
- in de natuur
De zuivere stof is opgebouwd uit één soort deeltjes. Als de zuivere stof is opgebouwd uit moleculen, dan zijn alle moleculen in die stof gelijk aan elkaar. De stof kan aangeduid worden met één molecuulformule. Zodra er andere moleculen bij zitten, is de boel onzuiver. Dan heb je een mengsel van stoffen.
Het kan zijn dat de zuivere stof is opgebouwd uit ionen. In dat geval zitten er verschillende ionen in de zuivere stof (positieve en negatieve). Noem je het dan wel een zuivere stof?
Neem nu zuiver keukenzout. Dat is opgebouwd uit twee soorten ionen, netjes gerangschikt in een ionrooster (Na+ en Cl-). De stof heeft één duidelijke formule: NaCl (de ionen zitten bij elkaar in de verhouding 1:1).
Als de stof zo is opgebouwd en aangeduid kan worden met één (verhoudings)formule, dan zeggen we ook: deze stof is zuiver. Zodra er andere, vreemde ionen bijkomen, of moleculen, dan heb je een mengsel, dan is het zout onzuiver geworden.
Bekijk op Youtube een klein filmpje.
Opdracht 15
Als we het hebben over fases, of aggregatietoestanden, behoort (aq) niet officiëel tot de fases.
Leg dat uit.
Hieronder staat een schema dat de modellen van elke fase laat zien op deeltjesnivo.
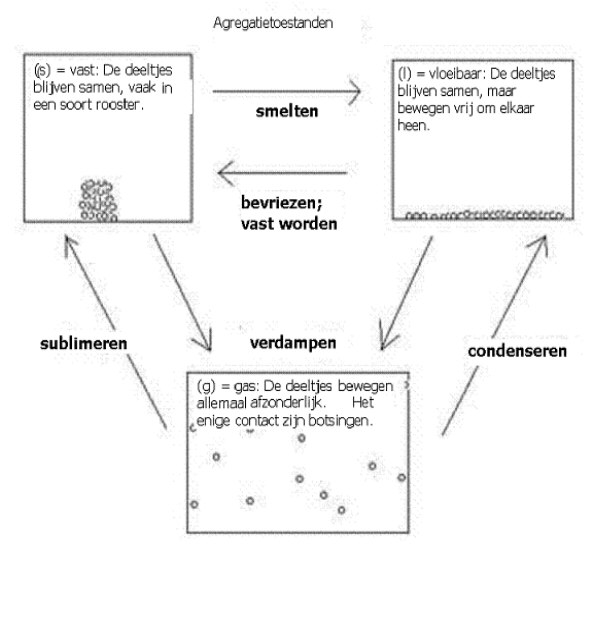
In vaste toestand bevinden de deeltjes zich op een vaste plek; ze kunnen zich niet verplaatsen. Wel zullen ze in trilling zijn, maar ze zijn niet mobiel. De trillingen zijn afhankelijk van de temperatuur. Als het vreselijk koud wordt, kunnen de trillingen helemaal ophouden.
Normaal vormen al die deeltjes tezamen een vast patroon, een rooster. In het groot zie je een kristalstructuur. Er zijn ook vaste stoffen zonder kristalstructuur: dat heet amorf. Voorbeelden hiervan zijn: glas, plastic en gel.
In de vloeibare fase hebben de deeltjes een zekere beweeglijkheid, ze kunnen zich verplaatsen, ze draaien wat om elkaar heen. Net als alle deeltjes, hebben ze ook nog een trillingsbeweging. Trillend rollen ze van de één naar de ander. De verplaatsing en de trilling zijn afhankelijk van het karakter van die deeltjes (bijvoorbeeld: zijn ze groot of klein) en van hun temperatuur (kinetische energie).
De deeltjes in een vloeistof vormen dus geen starre structuren, maar blijven ongeveer net zo dicht bijeen als in een vaste stof dankzij de onderlinge aantrekking. Het is een misverstand is om te denken dat een vloeistof precies zit tussen vast en gas. Vloeistoffen en vaste stoffen hebben een vergelijkbare dichtheid. Het feit dat de deeltjes zich kunnen verplaatsen, om elkaar heen kunnen draaien, veroorzaakt het vloeibare karakter.
In de gasfase zijn de deeltjes helemaal van elkaar gescheiden, ze bewegen zich afzonderlijk, ze hebben alle vrijheid daarvoor, afhankelijk weer van het karakter van de deeltjes en van de temperatuur.
Regelmatig zullen de gasdeeltjes onderling botsen (of ze botsen tegen de wand van de gashouder) en zo hun bewegingsrichting veranderen. Als ze niet genoeg energie (meer) hebben, bijvoorbeeld bij afkoeling, dan kan een botsing uitlopen op het bij elkaar blijven van de deeltjes → ze worden vloeistof of vaste stof.
N.B. Over vloeistoffen bestaat, zoals gezegd, een misconceptie (een onjuist idee):
In een vloeistof - net als in een vaste stof - blijven de deeltjes zeer dicht bij elkaar.
Het verschil met een vaste stof is dat de deeltjes niet vast zitten in een rooster, maar vrij langs elkaar kunnen bewegen; ze hebben kinetische energie genoeg daarvoor. Je kunt ook zeggen: de onderlinge aantrekkingskracht is niet genoeg voor het vormen van een rooster.
Als er energie wordt weggehaald, zoals bij afkoelen, dan gaan ze alsnog in een rooster zitten. Bij verhitting, dus als de deeltjes in een vloeistof meer energie krijgen kan het gebeuren dat ze zich van elkaar gaan verwijderen (naar gasfase).
In een vloeistof zitten de deeltjes dus zo dicht bij elkaar dat er geen mogelijkheid is (zoals bij gassen) om de stof samen te drukken.
(aq) gebruiken we heel vaak in de scheikunde, maar is geen fase. Het duidt op een mengsel waarbij een stof is opgelost in water.
NaCl(aq) wil dus zeggen: een oplossing van keukenzout in water.
Opdracht 16
Wat kun je waarnemen bij de volgende processen, en leg je antwoord uit:
- H2O(l) → H2O(g)
- CuSO4(aq) → CuSO4(s)
- Na2CO3.10H2O → Na2CO3(l)
In module 3 werden de verschillende chemische bindingen besproken en ook de zgn. intermoleculaire krachten: welke krachten houden de moleculen bij elkaar?
Een kort overzicht daarvan wordt hier herhaald, omdat het alles te maken heeft de aggregatietoestand, de fase waarin een stof zich liefst bevindt.
Van ionaire stoffen en metalen weten we dat ze stevig in elkaar zitten en moeilijk smelten (op enkele metalen na). Maar hoe zit het ook weer met moleculaire stoffen?
Binnen in een molecuul heersen 'intramoleculaire' krachten: de covalente bindingen.
Maar er bestaan ook krachten tussen moleculen onderling, die we 'intermoleculaire krachten' noemen.
We bespreken drie types:
VanderWaalskrachten
De Nederlandse onderzoeker Dr. van der Waals beschreef bepaalde krachten tussen moleculen, krachten waarmee moleculen elkaar aantrekken, ook als die moleculen a-polair zijn.
De aantrekking tussen apolaire moleculen, wordt door sommige auteurs de VanderWaalskrachten genoemd.
Maar er zijn ook boeken waar de VanderWaalskrachten op zowel de apolaire als op de polaire aantrekking slaan.
Het is niet eens zo vreselijk belangrijk hoe we ze noemen. Als je maar begrijpt dat er intermoleculaire krachten bestaan.
Deeltjes trekken elkaar aan omdat ze massa hebben.
De massa's van deeltjes kunnen - als ze elkaar benaderen - ook een zekere polariteit in elkaar veroorzaken (je noemt dat inductie).
Die is verantwoordelijk voor tijdelijke dipoolkrachten.
Het gaat hier niet om sterke krachten en ze zijn afhankelijk van het aantal elektronen in de deeltjes en hoe die te polarizeren zijn.
Het hangt ook samen met de grootte van de deeltjes.
Algemeen gesproken mogen we zeggen: de VanderWaalskrachten hangen samen met de molecuulmassa.
Dipoolkrachten
Net als polaire bindingen, hebben ook dipoolmoleculen (worden ook wel kortweg 'dipolen' genoemd) ladinkjes: δ+ (ietsje positief) aan één kant en aan de andere kant δ- (ietsje negatief).
Zodra twee moleculen elkaar ontmoeten zal de positieve kant van het ene molecuul de negatieve kant van een ander molecuul aantrekken.
De gelijk geladen kanten zullen elkaar afstoten.
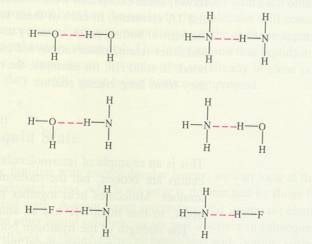
Waterstofbruggen
De waterstofbrug is een andere manier waarop moleculen elkaar kunnen aantrekken en vasthouden.
Deze vorm van aantrekking heeft direct te maken met het bestaan van dipoolmoleculen, maar is toch net iets meer:
Behalve de aanwezigheid van dipoolkrachten is er ook sprake van H-bruggen:
Een H-atoomδ+ bevindt zich tussen twee δ- -atomen.
Zo'n H-brug lijkt een ionbinding, maar krijgt in werkelijkheid een soort covalent karakter.
δ- δ+ δ-
O - H - - - O
Een H-brug kan zich vormen onder de volgende vier voorwaarden:
- Het geheel moet een lineaire structuur hebben (alle drie atomen liggen op één lijn).
- de aanwezigheid van een Hδ+ is voorwaarde.
- De δ- -atomen moeten aanwezig zijn, waarvan één vaak zuurstof is, maar niet noodzakelijk. (het kan bijvoorbeeld ook Stikstof zijn)
- Die streepjes (- - - ) geven de brug aan:
éen elektronenpaar van zuurstof kwam onder de invloedssfeer van het waterstof; zo begint een soort covalente binding te ontstaan.

Puur theoretisch, rekenkundig, zouden we 18 soorten mengsels van twee componenten kunnen onderscheiden, als we uitgaan van:
- we hebben drie verschillende fases,
- het mengsel bestaat uit twee componenten en
- elk mengsel kan zowel homo- als heterogeen zijn.
attentie: die derde voorwaarde kan niet volledig waar zijn.
|
(s) |
(l) |
(g) |
(s) |
(s) + (s) |
(s) + (l) |
(s) + (g) |
(l) |
(l) + (s) |
(l) + (l) |
(l) + (g) |
(g) |
(g) + (s) |
(g) + (l) |
(g) + (g) |
Het schema toont 9 theoretische mengsels die (ook theoretisch) allemaal homogeen en heterogeen kunnen zijn. Let wel, dit is een theoretische benadering.
De praktijk is echter anders:
- (l) + (s) en (s) + (l) zijn gelijk aan elkaar.
- (g) + (g) is altijd homogeen; de heterogene vorm bestaat niet.
- (g) + (s) komt alleen voor in heterogene mengsels.
- .................................
- .................................
Opdracht 17
Probeer de open lijnen in te vullen.
Een paar voorbeelden:
- een mengsel van zout- en suikerkristallen: (s) + (s) heterogeen
- een mengsel van CO2 in water (spuitwater) is homogeen, maar wordt heterogeen op het moment dat de fles wordt geopend
- lucht is een mengsel van gassen (altijd homogeen)
Opdracht 18
Wat zijn dat ook weer voor mengsels die je aanduidt met (aq)?
Opdracht 19
Hoeveel verschillende echte mengseltypes kun je noemen?
- 18
- 12
- 11
- 10
- 9
- 6
Leg je keuze uit.
Opdracht 20
Als je bier opvat als een mengsel van water en alcohol, wat voor type mengsel is dat dan?
Antwoord 05-20
Opdracht 21
Wat voor mengseltype is brons?
Een zeer veel gebruikt mengsel in de scheikunde is: (s)+(l) /homogeen
(s) is een of andere vaste stof opgelost in (l), bijvoorbeeld water (er zijn allerlei oplosmiddelen!).
Een 'wateroplossing' is natuurlijk een mengsel met water als oplosmiddel. De opgeloste stof kan (s), (l) of (g) zijn.
Opdracht 22
1 liter 1,0 M NaCl (je spreekt dat uit als: 1 molair NaCl) bevat 1 mol NaCl-deeltjes.
Hoeveel mol ionen Cl- en Na+ bevinden zich in 0,2 mol NaCl?
Opdracht 23
Stel dat je een literfles bier kapot laat vallen. Het bier heeft een Vol% van 6 (zwaar bier dus). De dichtheid van alcohol is 0,8 g/ml (of kg/l).
Hoeveel moleculen alcohol heb je dan laten vallen?
Antwoord 05-23
Opdracht 24
Een biertje kan 5%Vol alcohol bevatten.
Bereken de concentratie [C2H5OH] in mol/L

Opdracht 25
Er wordt gezegd dat een goede kwaliteit steenkool minder dan 1 massaprocent zwavel bevat.
Als je dan 1 ton steenkool met 1 massaprocent zwavel opstookt, hoeveel kilo's zwavel worden dan tegelijk verbrand?
Is het je duidelijk dat steenkool niet bepaald milieuvriendelijk is?
Nu zou het mooi zijn als je ergens wat jodium kon zien. Misschien op school? Let wel, jodium voor ontsmetting is een oplossing van puur jodium(s) in een vloeistof.
Zuiver jodium (soms noemt men het jood) is een vaste stof, opgebouwd uit donkerpaarse, bijna zwarte kristallen. Als je zo'n kristal vastpakt, hou je meteen bruine vlekken over op de huid van je vingers. Een beetje van het kristal is verdampt door de warmte van je huid en blijft in het vocht van je huid zitten met een bruine kleur.
Je zou moeten waarnemen wat er gebeurt als puur jodium verdampt. Jodium smelt namelijk niet, maar gaat van vast meteen over in damp, in gasvorm.
Als het oplost in alcohol krijg je jodiumtinctuur (te koop bij de drogist). Dit is het jodium dat prikt (omdat er alcohol in zit).
Er is ook een andere manier om jodium op te lossen: met een truukje in water, en dan prikt het niet als je er een wondje mee ontsmet.
Nu moet je het onderstaande schema bekijken / bespreken: je ziet modellen van verbindingen met waterstof van elementen uit de tweede periode van het periodiek systeem (C, N en O)
| methaan |
ammoniak |
water |
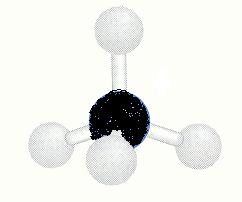 |
 |
 |
| CH4 |
NH3 |
H2O |
tetraëder
geen dipool |
dipool |
dipool |
| k.p. 112 K |
k.p. 240 K |
k.p. 373 K |
De binding tussen C en H is nauwelijks polair. De bindingen tussen O en H en de bindingen tussen N en H zijn polair genoeg.
Als een molecuul polaire bindingen bevat, dan zijn er de volgende twee mogelijkheden:
- De ruimtelijk opbouw van het molecuul is zodanig dat de zwaartepunten van positieve en negatieve ladingen niet samenvallen. Dit is het geval bij ammoniak en bij water.
- De zwaartepunten van de negatieve en positieve ladingen vallen (ongeveer) samen. Het beetje polair karakter van de bindingen tussen C en H in methaan levert geen dipoolmolecuul op. het molecuul is volkomen symmetrisch.
Ammoniak zal goed in water oplossen, maar methaan niet.
| symmetrisch: |
 |
| asymmetrisch: |
 |
SO2 zal ongetwijfeld beter in (het polaire) water oplossen dan CO2
Even ter herinnering:
Het belangrijkste gegeven van een zuivere stof is dat die is opgebouwd uit slechts één soort deeltjes.
Zo is bijvoorbeeld suiker zonder onzuiverheden opgebouwd uit alleen maar sacharosemoleculen (C12H22O11).
Opdracht 26
Zuiver keukenzout is opgebouwd uit ionen van natrium en chloor. Is deze stof zuiver of niet? Leg je antwoord uit.
INTERMEZZO over het polaire karakter van moleculen
Ter herinnering:
De mate waarin atomen geneigd zijn negatieve deeltjes, meestal elektronen, aan te trekken, noemt men ELEKTRONEGATIVITEIT (zie module 3).
De elektronegativiteit wordt afgekort met de letter E.
Of die elektronen (die negatieve deeltjes) makkelijk of moeilijk worden aangetrokken door de neutrale atomen [en eventueel worden opgenomen] is o.m. afhankelijk van de kernlading (positieve lading) en van de atoomstraal (afstand).
Hoe groter de kernlading, des te sterker de aantrekkingskracht op de negieve deeltjes;
Hoe groter de afstand tot de kern, des te zwakker wordt die aantrekkingskracht.
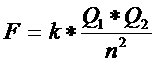
Opdracht 27
Leg uit dat een chlooratoom fanatieker elektronen wil opnemen dan een joodatoom.
In het periodiek systeem neemt de kernlading van links naar rechts toe, terwijl het aantal hoofdschillen gelijk blijft. De buitenste hoofdschil wordt dus steeds sterker aangetrokken en het atoom wordt naar rechts kleiner.
Dit heeft tot gevolg dat de aantrekkingkracht van het atoom op de negatieve deeltjes (binnen en buiten het atoom) toeneemt en dat dus de elektronegativiteit gedurende één periode van links naar rechts sterker wordt.
Opdracht 28
Zoek in tabel 5 of in het BINAS tabellenboek de derde periode op en noteer de E voor elk element; noteer ook de atoomstraal van elk element en leg uit waarom deze straal steeds kleiner wordt.
Antwoord
De atoomstraal wordt in het periodiek systeem van boven naar beneden groter omdat omdat er steeds een hoofdschil bij komt.
Negatieve deeltjes (zoals elektronen) worden dan ook door de atomen van boven naar beneden steeds minder sterk aangetrokken omdat ze steeds verder van de kern verwijderd zijn.
Opdracht 29
Zoek in de tabel de zevende hoofdgroep op en noteer van boven naar beneden zowel de atoomstraal als de E (in een tabelletje).
Schets een grafiekje: atoomstraal op de x-as en E op de y-as
Je moet dit verloop kunnen verklaren.
Als een molecuul een asymmetrische ladingsverdeling heeft, dan heeft dat molecuul ook een zogenaamd dipoolmoment:
dipoolmoment = ladingsgrootte x afstand.
Met die afstand bedoelt men de afstand tussen de zwaartepunten van de ladingen.
Opdracht 30
Zoek in de tabellen van het BINAS tabellenboek de bindingsafstanden, de bindingshoeken en de dipoolmomenten op van de moleculen van kooldioxide, zwaveldioxide, en zwaveltrioxide.
Verklaar het dipoolmoment van de laatste.
Opdracht 31
De dipoolmomenten op van de vier waterstofhalogeniden zijn als volgt:
|
|
bindingsafstand
|
dipoolmoment
|
| HF
|
90 x10-12m
|
6,4
|
| HCl
|
130 x10-12m
|
3,5
|
| HBr
|
140 x10-12m
|
2,7
|
| HI
|
160 x10-12m
|
1,4
|
Leg deze gegevens uit met de theorie.
Als het dipoolmoment van een molecuul ongeveer 0 is, dan is deze stof apolair; zo niet, dan is de stof polair. Polaire stoffen hebben dipoolmoleculen.
Polaire stoffen, dus stoffen met ionen of stoffen met dipoolmoleculen, mengen goed met andere polaire stoffen; bijvoorbeeld: water met alcohol.
Apolaire stoffen mengen goed met apolaire stoffen; bijvoorbeeld: vet met olie.
Polaire stoffen mengen niet goed met apolaire stoffen (en andersom): water en olie.
Kortom:
"SOORT ZOEKT SOORT".
Opdracht 32
Meng joodwater (polair) met wat tetra of petroleumether (apolaire oplosmiddelen) en verklaar je waarnemingen.
Opdracht 33
Leg uit waarom olie en vet apolair zijn.
Uit bovenstaande blijkt al dat de aanwezigheid van ladingen in een molecuul de eigenschappen van dat molecuul sterk beïnvloeden.
Als in één molecuul of in een samengesteld ion twee gelijksoortige ladingen dicht in elkaars buurt zitten, beïnvloeden ze elkaar: afstoting; daardoor krijgt de stof opvallende eigenschappen.
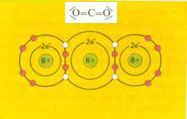
Een voorbeeld daarvan is ethaandizuur ofwel oxaalzuur:
De C - C binding in het midden staat onder grote spanning (door de afstotende werking van de positieve ladingen).
Dat verzwakt die C - C binding. Het gevolg is dat oxaalzuur (in tegenstelling tot gewone carbonzuren) vrij gemakkelijk kapot gaat = gemakkelijk te oxideren is.
Normaal is een C-C binding moeilijk stuk te krijgen.
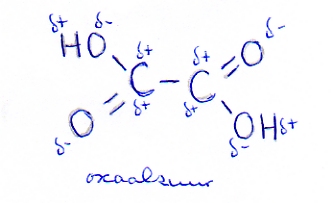
Opdracht 34
Controleer in een tabellenboek of oxaalzuur inderdaad een geschikte reductor is.
Een ander voorbeeld is: Kationzuren (zie ook module 9)
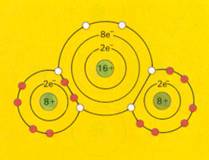
Als je een ijzer(III)zout in water oplost, krijg je in het centrum een klein en sterk positief ijzer ion met dicht daaromheen een aantal watermoleculen.
De δ--kant van de zuurstofatomen wordt aangetrokken door dat positieve ijzerion. De enigzins positieve H-atomen van het water (de δ+-kant) komen dan vanzelf in de invloedssfeer van datzelfde ijzerion en ondervinden een afstotende kracht.
Er zijn zo een aantal complexe ionen die in staat zijn H+ af te splitsen en dus als een zwak zuur op te treden (kationzuur).
Opdracht 35
Zoek in de tabel met zuren en basen, bijvoorbeeld in het BINAS tabellenboek, de drie chloorethaanzuren op en verklaar hun verschil in zuursterkte.
einde intermezzo
De meeste vaste stoffen zijn opgebouwd als rooster, met één of een paar verschillende deeltjes. De krachten waarmee die deeltjes elkaar onderling aantrekken kan erg verschillen en is bepalend voor de eigenschappen van die stof.
Metaalrooster
Het merendeel van de metalen bezit sterke aantrekkingskrachten tussen de positieve metaal-ionen en de negatieve vrije elektronen in het metaalrooster (zie ook module 3).
De vrije elektronen kun je beschouwen als een soort lijm die de ionen op hun plaats houdt in het rooster.
Het eigenlijke rooster is dus de regelmatige rangschikking van de metaal-atoomrompen. In metaalroosters heersen dus sterke ladingskrachten.
Enkele eigenschappen van metalen zijn: metaalglans, geleidbaarheid voor elektriciteit, ze zijn vast (behalve kwik) en hebben vaak vrij hoge smeltpunten.
Ionrooster
In zouten heb je sterke aantrekkingskrachten tussen positieve en negatieve ionen. (zie module 3)
Deze inter-ionaire krachten bepalen de sterkte van het rooster en dus ook het smeltpunt. Doorslaggevend hierbij zijn de lading van de ionen en de afstand tussen de ionen (d.w.z. die wordt bepaald door de ionstralen). Een sterk rooster heeft kleine ionen met hoge lading.
Zo heeft bijvoorbeeld MgO een veel sterker ionrooster dan NaCl, omdat de magnesium en zuurstofionen kleiner zijn en sterker geladen dan de natrium en chloride-ionen.
In zo'n ionrooster zitten de positieve en negatieve ionen netjes gerangschikt. Daarbinnen heersen dus altijd sterke ladingskrachten.
Kenmerken: kristallijn, hoog smeltpunt, als vloeistof (dus in gesmolten toestand) geleidend. De kristallen echter geleiden niet!
Molecuulrooster
Bij het merendeel van de vaste stoffen en vloeistoffen worden de deeltjes bij elkaar gehouden door de volgende intermoleculaire aantrekkingskrachten:
- de niet zo sterke vanderWaals-krachten, ook wel 'massakrachten' genoemd
- polaire krachten in geval van dipoolmoleculen
- waterstofbruggen
Bij de vaste stoffen zullen - onder invloed van deze krachten - de deeltjes meestal in een molecuulrooster zitten. Molecuulroosters worden sterker als de moleculen méér dipoolkarakter hebben (een groter dipoolmoment hebben) én als ze zwaarder zijn (grotere molecuulmassa, dus sterkere vdWkrachten).
Opdracht 36
Zoek in het BINAS tabellen boek een tabel met vaste stoffen. Kies daaruit voor elk roostertype 2 stoffen op en controleer hun smeltpunt. Klopt het met de theorie?
Over het algemeen zijn de aantrekkingskrachten in molecuulroosters minder sterk dan in metaalroosters of ionroosters. Dus zullen molecuulroosters ook lagere smeltpunten hebben. Zijn de aantrekkingskrachten echt zwak, dan heb je bij normale temperatuur helemaal geen rooster, maar is de stof vloeibaar of gasvormig.
Stoffen met molecuulroosters zullen meestal atoombindingen hebben binnen de deeltjes (de moleculen), dus meestal uit niet-metalen opgebouwd zijn.
Bij uitzondering komen er vaste stoffen voor zonder duidelijke roosterstructuur (amorf) én stoffen met een atoomrooster, zoals diamant.
Naast amorfe koolstof zijn er twee bekende roosterstructuren:
- diamant met kubische kristallen en een dichtheid van 3,5
- grafiet met hexagonale kristallen en een dichtheid van 2.2
Het is technisch mogelijk om grafiet onder zo'n hoge druk samen te persen dat de dichtheid verhoogd wordt tot die van diamant.
Je kunt zo kunstmatig diamant maken uit grafiet.
|
De molecuulroosters zijn geen geleiders; hoogstens halfgeleiders.
Een faseverandering is niet echt een chemische verandering, geen chemische reactie (hoewel het verschil niet altijd even duidelijk is).
Als er intern iets gebeurt met de deeltjes van de stof (ze ondergaan echte verandering) dan heb je een scheikundige reactie, maar als die deeltjes alleen maar veranderen in positie, trilling, energie, e.d. maar vanbinnen blijven ze gelijk, dan spreken we meer van fysische veranderingen. Dat kunnen dus faseveranderingen zijn.
Zo kunnen deeltjes in een rooster (vaste stof dus) op een paar manieren uit elkaar vallen:
- Bij smelten (als een stof in droge vorm wordt verhit).
- Bij oplossen (gebeurt altijd in een oplosmiddel, zoals water)
Als een stof met een ionrooster smelt ((s) → (l)) of oplost ((s) → (aq)), heeft dat tot gevolg dat de ionen vrij door elkaar heen gaan bewegen.
De bekende faseovergangen zijn:
(s)  (l) (l) |
smelten of stollen |
(l)  (s) (s) |
stollen |
(l)  (g) (g) |
koken / verdampen |
(g)  (l) (l) |
condenseren |
(l)  (g) (g) |
verdampen |
(s)  (g) (g) |
sublimeren |
(g)  (s) (s) |
desublimeren of rijpen |
Het is leuk om op Youtube filmpjes over dit onderwerp te zoeken. bijvoorbeeld het volgende
Fase-overgangen zijn dus niet altijd echte chemische reacties; ze behoren tot de natuurkundige verschijnselen. Let er dus op dat bijvoorbeeld koken iets heel anders is dan ontleden!!!! Dit wordt nogal eens door elkaar gehaald. Ook zijn er stoffen die bij verhitting niet smelten of koken, maar voortijdig gaan ontleden (bijv. suiker).
Opdracht 37
Beschijf zo schematisch mogelijk de volgende twee processen:
- het "koken" van suiker (theoretisch)
- het ontleden van suiker (wat in de praktijk gebeurt als je suiker verhit)
Een paar voorbeelden van veranderingen van aggregatietoestanden, faseveranderingen:
- smelten van ijs: H2O(s)
 H2O(l)
H2O(l)
- benzine verdampt: C8H18(l)
 C8H18(g)
C8H18(g)
- lood kan ook smelten: Pb(s)
 Pb(l)
Pb(l)
Smeltpunten en kookpunten
1. Het ROOSTER is de belangrijkste factor bij het vaststellen van een smeltpunt
Hoe sterk is het rooster? Hoe gemakkelijk kun je het smelten?
Smelten betekent dat het rooster wordt vernietigd en het kost nogal wat energie om een sterk rooster kapot te maken.
De sterkte van een ionrooster hangt af van de ladingen van de ionen en van hun onderlinge afstanden.
Het rooster van CaO (met ladingen 2+ en 2-) zal moeilijker smelten dan dat van NaCl (met ladingen 1+ en 1-). Behalve de ladingen zijn ook nog eens de ionen van CaO kleiner.
Kleinere ionen veroorzaken sterkere roosters. (ze zitten dichter op elkaar)
Zouten zullen over het algemeen hoge smeltpunten hebben.
Ook de metaalroosters hangen af van ladingen en afstanden.
Tussen de metalen bestaan nogal wat verschillen: over het algemeen zal een metaalrooster sterk zijn (dus hoog smeltpunt), maar er zijn uitzonderingen:
Kwik(l) is bij gewone temperatuur al vloeibaar. Lood, tin, lithium, natrium, kalium hebben geen sterke roosters. Ze smelten gemakkelijk.
Extreem sterk zijn de roosters van: Chroom, Wolffraam en Vanadium. Zie ook tabel 5)
|
2. VANDERWAALS-KRACHTEN zijn de tweede factor bij het vaststellen van smeltpunten.
Deze bestaan vooral in molecuulroosters waarvan de sterkte afhankelijk is van:
- de deelname van Waterstofbruggen
- de deelname van polaire atomen (met δ- of δ+)
- de molecuulmassa's. Grote moleculen veroorzaken hogere smeltpunten dan kleine.
Stoffen met molecuulroosters hebben niet zo hoge smeltpunten.
|
Smeltpunten zijn dus afhankelijk van de roostersterkte:
- Let eerst op de aanwezigheid van ladingskrachten; hoe groot zijn de ladingen en de ionstralen?
- Onderzoek vervolgens de VanderWaalskrachten, die afhankelijk zijn van de molecuulmassa's.
Opdracht 38
- Plaats de volgende stoffen in volgorde van toenemend smeltpunt:
- Keukenzout, kaliumchloride, broom, water, ongebluste kalk, grafiet.
Kookpunten zijn (in volgorde van belangrijkheid) afhankelijk van:
- Ladingskrachten tussen de deeltjes onderling (zijn het ionen of dipoolmoleculen?)
- VanderWaalskrachten; dus de M(olecuulmassa's) vergelijken.
- De ruimtelijke vorm van de deeltjes:
Hoe bolvormiger een molecuul is, des te kleiner is haar oppervlak, des te kleiner de onderlinge aantrekkingskracht,
dus des te lager het kookpunt. De bolvormige deeltjes ontsnappen gemakkelijker (het kookt dan makkelijker).
Opdracht 39
- Plaats de volgende stoffen in volgorde van toenemend kookpunt:
- water, stikstof, hexaan, 2.3-dimethylbutaan, glycerol.
Antwoord 05-39
Gasvormige stoffen bij kamertemperatuur, over het algemeen, hebben geen of weinig aantrekkingskrachten tussen de deeltjes. Die zijn niet polair en hebben geen waterstofbruggen.
Opdracht 40
Leg de karakteristieken uit van de grafiek:
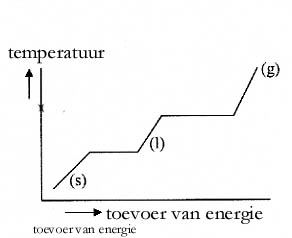
N.B.
Faseveranderingen worden niet beschouwd als chemische reacties, maar let op: het is niet altijd zo gemakkelijk om scheikundige en natuurkundige processen te onderscheiden.
Er zijn ook stoffen die nooit toekomen aan een smeltpunt of aan een kookpunt. Al voordat ze aan die temperatuur toekomen, gaan ze ontleden (dat is zeker een chemisch proces).
Opdracht 41
Bekijk op youtube dit filmpje over verhitting van suiker
Geef de vergelijkingen van de volgende "reacties":
- suiker "smelten" en suiker "koken"
- suiker ontleden
Verdamping
Opdracht 42
bewering: Tijdens verdamping van vast I2 vormen zich jodium-atomen.
Is deze bewering waar of onwaar? Leg uit
Bekijk nog een keer het volgende
Antwoord 05-42
Als de deeltjes van een vloeistof meer energie krijgen, of zelfs als roosterdeeltjes energie toegevoerd krijgen, bijvoorbeeld doordat de stof verwarmd wordt, verhoog je de beweging en trilling van de deeltjes.
Op zeker punt zal die beweging zo hevig worden dat de deeltjes niet meer bij elkaar kunnen blijven: De onderlinge aantrekkingskrachten zijn dan niet meer voldoende om ze bij elkaar te houden.
Als ze zich helemaal van elkaar losmaken, dus bij gasvorming, kunnen die deeltjes nog heel goed met elkaar in botsing komen. Maar ze zullen dan toch niet samenblijven. Wel bij afkoeling natuurlijk. Dan kunnen stoffen weer vloeibaar of vast worden.
Opdracht 43
Kies het juiste antwoord en leg je keuze uit:
Aspirine lost niet op in water omdat:
- aspirine een vaste stof is en water een vloeistof
- aspirinemoleculen geen polair karakter hebben
- het water geen maagzuur bevat
- het smeltpunt van aspirine te hoog is.

stof met ionen die in water oplost: Natriumchloride
| Na+
|
Cl-
|
Na+
|
Cl-
|
Na+
|
| Cl-
|
Na+
|
Cl-
|
Na+
|
Cl-
|
| Na+
|
Cl-
|
Na+
|
Cl-
|
Na+
|
| Cl-
|
Na+
|
Cl-
|
Na+
|
Cl-
|
| Na+
|
Cl-
|
Na+
|
Cl-
|
Na+
|
| Cl-
|
Na+
|
Cl-
|
Na+
|
Cl-
|
De ionen Na+ en Cl- die uit een rooster ontsnappen (dat gebeurt aan het oppervlak van het kristal) worden meteen omringd door watermoleculen (door de polaire aantrekkingskrachten).
De ionen trekken elkaar nog wel aan, maar niet genoeg om weer een rooster te vormen. Die watermoleculen zitten in de weg.
We hebben het hier over een oplosbaar zout.
Andere ionen, kleinere of meer geladen, ook omringd door watermoleculen (=gehydrateerd), kunnen vaak wel weer bij elkaar komen en een rooster vormen. Hun onderlinge aantrekking is groot genoeg om daarin te slagen.
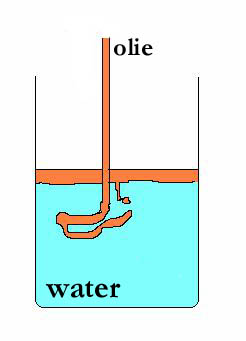
heterogeen mengsel: (voorbeeld) olie + water
De polaire moleculen van water trekken elkaar sterk aan, terwijl de apolaire olie-moleculen bij elkaar blijven en de boel is niet in staat goed te mengen.
Algemene regel:
SOORT ZOEKT SOORT
- polaire stoffen trekken polaire stoffen aan (zoals suiker dat goed oplost in water)
- niet-polaire stoffen trekken niet-polaire stoffen aan (voorbeeld: vet in benzine)
- polaire stoffen mengen niet met apolaire stoffen (zoals bij water en olie)
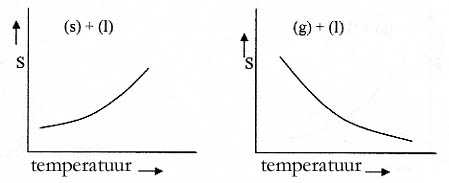
Opdracht 44
Vergelijk de twee grafieken en trek je conclusies (S = oplosbaarheid)
Materie, of dat nu een zuivere stof is of een mengsel, kan elektrische stroom geleiden als er in die materie aanwezig zijn: geladen deeltjes die zich kunnen verplaatsen met voldoende beweeglijkheid.
Als dus ionen zich vrij kunnen bewegen door een stof (dus als ze in een smelt of in een oplossing zitten), dan is die stof geleidbaar voor elektrische stroom.
Opdracht 45
Leg uit of de onderstaande stoffen de elektrische stroom zullen geleiden, vul in: ja of nee
| keukenzout(aq) |
|
| gedestilleerd water |
|
| kalk(s) |
|
| koper(s) |
|
| leidingwater |
|
| kalkwater |
|
| kwik |
|
De ene geleidende stof doet het beter dan de andere; niet alle geleiders zijn even goed.
De geleidbaarheid is afhankelijk van:
- De concentratie van de geladen deeltjes, hun aantal, hoe meer, hoe beter de geleiding. Een hoge concentratie geleidt beter dan een lage concentratie.
- De beweeglijkheid van de geladen deeltjes. Kleine ionen geleiden meestal beter dan grote ionen. Hierbij moet je wel bijv. de hydratie (de watermantel) in de gaten houden. Soms kunnen kleine ionen erg gehinderd worden in hun beweeglijkheid door de omringende opdringerige watermoleculen.
- Een gehydrateerd ion verplaatst zich dus trager, maar let op: gehydrateerde waterstofionen hebben op hun beurt een bijzonder mechanisme om juist zeer snel te bewegen en dus heel goed te geleiden.De H+ van de ionen H3O+worden supersnel overgedragen van het ene ion naar een ander.
Toepassingen van geleidende stoffen vind je o.a. bij: stroomdraden, elektroden, zoutbruggen, elektrolyse.
Opdracht 46
Onderstaande stoffen geleiden elektriciteit. Leg uit waarom:
- Alle metalen
- Grafiet
- Oplossingen met ionen
- Gesmolten keukenzout
Opdracht 47
Zullen de volgende stoffen elektriciteit geleiden? Leg uit.
- calciumchloride(s); lood(l); water(l); ijs(s); keukenzout(aq); diamant; olie; azijnzuur(aq); azijnzuur(l).
De hardheid van vaste stoffen kan sterk variëren, afhankelijk van de driedimensionale structuur en van de krachten die deze structuur bij elkaar houden.
Hoe meer ion-karakter, des te harder zal de stof zijn.
In ionroosters en metaalroosters kunnen de ionen intern zich niet verplaatsen.
De hardste stof is diamant dat een atoomrooster heeft van koolstofatomen. Elk C-atoom is verbonden met vier andere C-atomen, waardoor, als je het goed bekijkt, een diamant eigenlijk één groot reuzenmolecuul is. Het heeft een perfecte structuur; elk deeltje zit via atoombinding aan elkaar.
Polimeren zijn opgebouwd uit macromoleculen die ook een beetje ronde, ruimtelijke vorm kunnen hebben, maar dat is niet altijd ze. Zijn de moleculen lang zonder dwarsverbindingen, dan zal het waarschijnlijk gaan om zacht plactic. Maar als er dwarsverbindingen zijn dan kan het hard plastic zijn. Bij verwarming kan het zachte plastic min of meer smelten, maar het harde niet. Er wordt ook wel gesproken van thermoplast en thermohard.
Hygroscopische stoffen nemen graag water op, ook waterdamp uit de atmosfeer. Daarom worden ze gebruikt als droogmakers, bijvoorbeeld in verpakkingen van elektronische apparatuur. Als ze water hebben opgenomen wordt dat water ingebouwd in de kristallen en blijft die stof vast en heel lang ook droog. De watermoleculen worden ingebouwd in de ionroosters.
Voorbeelden: koper(II)sulfaat (lichtblauw); calciumchloride; natriumcarbonaat; en vele andere zouten. Maar ook fosforpentoxide (P2O5) is buitengewoon hygroscopisch, zij het dan dat deze stof niet alleen maar het water opneemt, maar er ook mee reageert.
Opdracht 48
Gedehydrateerd (dus droog) koper(II)sulfaat wordt gebruikt om de aanwezigheid van kleine hoeveelheden water in een mengsel te bewijzen.
Leg uit wat je dan ziet; welke observaties moeten gedaan worden?
Gips, Cement, Bakstenen
Gips heeft de formule (CaSO4).2H2O en kan veel kristalwater (langzaam) opnemen. Meng je watervrij gips dus met water dan zal het eerst nog een mengsel zijn van (l) + (s), maar na het opnemen van het water(l) in de vaste stof hou je nog steeds vaste stof over: gehydrateerd gips (hard spul).
(CaSO4)2.H2O(s) + 3H2O(l)
 2CaSO4.2H2O(s)
2CaSO4.2H2O(s)
De grondstof voor cement is een mengsel van calciumcarbonaat + aluminium- en siliciumoxides. Je moet het mengsel heel sterk verhitten; dan gaat het carbonaat over in CaO.
Bij temperaturen boven 1500ºC verlopen reacties tussen al die oxides van calcium, aluminium en silicium en worden zouten gevormd zoals silicaten en aluminaten van calcium, vaak ook nog in aanwezigheid van ijzer. Het eindmengsel wordt flink vermalen en dat wordt in de handel gebracht onder de naam Portland Cement.
Dit cement is bijzonder hygroscopisch. Met water vormt het een mengsel dat binnen enkele uren extreem hard wordt.
Water komen we op onze planeet wel het meest tegen. De volgende stof in overvloed, na water, is zand, waarvan de hoofdcomponent SiO2 is.
De andere componenten zijn bijvoorbeeld verbindingen van ijzer (geeft de bruine kleur aan zand) en verbindingen met Aluminium. Naast siliciumoxide bevinden zich vele silicaten in de grond.
Klei bevat ook aluminiumsilicaten, d.w.z. silicaatverbindingen waarin een deel van de silicium-atomen vervangen zijn door aluminium-atomen.
Klei heeft een soort opgevouwen structuur, veroorzaakt door macromoleculen. Die hebben een tweedimensionale structuur en - in aanwezigheid van water - kunnen die gemakkelijk over elkaar bewegen. Daarom voelt klei glibberig.
Maar als je klei zeer sterk gaat verhitten (bakken) verdwijnen de watermoleculen, de opgevouwen lagen komen heel dicht bij elkaar en vormen dan driedimensionale verbindingen, dwarsverbindingen. Een zeer harde structuur is het gevolg: baksteen en keramiek in verschillende kwaliteiten.
ACTIE-OPDRACHT
Deze opdracht is natuurlijk alleen mogelijk als je - bijvoorbeeld op school - beschikt over een laboratorium.
| Het is de bedoeling dat je een aantal stoffen gaat onderzoeken aan de hand van onderstaande 6 punten. |
Je krijgt een potje met een nummer; je weet niet wat er in zit.
Na elke waarneming moet je proberen een (voorlopige) conclusie te trekken. |
| De te onderzoeken stoffen kunnen zijn: |
De 6 aandachtspunten voor elke stof zijn: |
- jodium
- fosforpent(a)oxide
- aceton
- ethanol (alcohol)
- magnesiumhydroxide
- kool(stof)disulfide
- ammoniumchloride (salmiak)
- zwavelzuur(aq)
- lood
- zwavel
- tetra (vlekkenwater)
- paraffine
- zink
- water
- calciumoxide (ongebluste kalk)
|
- Beschrijf het uiterlijk van de stof.
- Indien de stof (s) is, onderzoek dan:
- de oplosbaarheid in (a)polaire stoffen
- of het smeltpunt hoog of laag is
- de geleidbaarheid voor elektrische stroom
- Indien (l), onderzoek dan:
- de mengbaarheid van deze stof met (a)polaire vloeistoffen
- of het kookpunt hoog of laag is
- de geleidbaarheid voor elektrische stroom
- Ga na of de stof (alleen in waterige oplossing) zuur of basisch reageert.
- Gebruik gegevens uit tabellen als je een vermoeden hebt welke stof je aan het onderzoeken bent; noteer uit welke tabellen die gegevens afkomstig zijn.
- Welke stof denk je dat het is? Waarom denk je dat?
|
De methode om een mengsel van stoffen te scheiden in componenten hangt af van het karakter van dat mengsel en van de componenten.
Zo heeft het bijvoorbeel geen zin om een homogeen mengsel te filtreren.
Om de beste methode te kiezen moet je de eigenschappen van de stoffen goed kennen.
Bij wikipedia vind je ook een mooi overzicht van de scheidingsmethoden
Bij extractie van een vast mengsel voegt men een oplosmiddel toe waarin één van de componenten oplost en de andere niet.
Vervolgens kun je de oplossing scheiden van de overblijvende niet opgeloste stof(fen) en filtreren.
Tenslotte kun je - indien gewenst - het oplosmiddel weer verdampen; dan houd je die ene oplosbare stof in vaste vorm over.
Zo kan heet water bepaalde stoffen extraheren uit theeblaadjes. Je scheidt dan componenten van elkaar en de oplosbare drink je op. De overblijvende stoffen (die achterbleven in de theeblaadjes) gooi je weg.
Een mengsel van jodium en kaliumpermanganaat kun je scheiden door alcohol toe te voegen. Het jodium lost op, maar het zout niet.
En bedenk wat er bij koffie zetten gebeurt.
Opdracht 49
Maak een schets van het scheiden door extractie van bepaalde kleurstoffen uit bloemen.
Veronderstel daarbij dat deze kleurstoffen in alcohol oplossen; de niet-oplosbare blijven achter als 'residu'.
Enkele bijzonder extracties zijn:
- verhitting van hetzelfde mengsel (jodium + permanganaat (= (s) + (s)) zal het jodium verdampen. Maar direct bij enige afkoeling sublimeert het aan de wanden van een glazen trechter en heb je de joodkristallen meteen terug, gescheiden van het zoutkristal.
- uit een mengsel van ijzer en zwavelpoeder kun je het ijzer "extraheren" met een magneet.
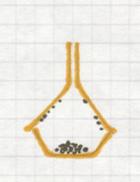

Chromatografie (zie ook wikipedia) wordt heel vaak toegepast in de chemische laboratoria:
Een mengsel (dus met verschillende deeltjes) passeert een vaste laag (papier, gel van aluminiumoxide, of andere poreuze stoffen)
De verschillende deeltjes van het opgeloste mengsel worden meer of minder sterk geabsorbeerd door die vaste laag (afhankelijk van, bijvoorbeeld, polaire eigenschappen).
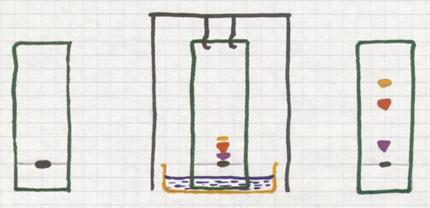
Plaats op een stukje filtreerpapier een klein stipje zwarte inkt (dat is zeker een mengsel van diverse kleurstoffen).
Kies een 'loopvloeistof' waar je het papier met de onderkant in hangt. Door de capillaire werking trekt die vloeistof naar boven, passeert het inktvlekje. Op dat moment neemt die vloeistof de componenten met verschillende snelheden mee naar boven.
Zo zal de slechtst oplosbare component vrijwel op zijn plaats blijven, niet naar boven mee trekken. Maar een component die redelijk oplost in die loopvloeistof, die zal meetrekken naar boven. Zo haal je de componenten uit elkaar en zie je aan het eind enkele vlekjes met diverse kleuren.
Opdracht 50
Denk je dat het mogelijk is om een (g) + (g) mengsel door papierchromatografie te scheiden in de componenten? Leg uit.
Antwoord 05-50
Elektroforese en Chromatografie
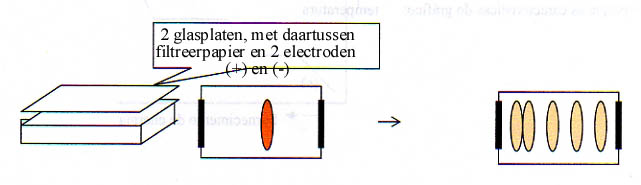
Het speciale filterpapier wordt natgemaakt met een waterige oplossing die aangezuurd, basisch of neutraal kan zijn.
In het midden breng je een vlekje aan van bijvoorbeeld een proteïnemengsel.
De eiwitten bewegen zich o.i.v. een elektrisch veld, en overeenkomstig hun lading, in een bepaalde richting:
- proteïnen in basisch milieu (OH- aanwezig) hebben meestal een negatieve lading
- proteïnen in zuur milieu (H+ aanwezig) hebben meestal een positieve lading
- de proteïnen in hun iso-elektrisch punt (daarover later) zijn neutraal
Het resultaat dat je in de afbeelding kunt zien geeft aan dat er waarschijnlijk een aangezuurde vloeistof is gebruikt om het filtreerpapier te bevochtigen.
Opdracht 51
Leg de werking van het afgebeelde apparaat in details uit.
Er zijn verschillende chromatografische methoden, zoals:
- Papierchromatografie
- Kolomchromatografie
- Gaschromatografie
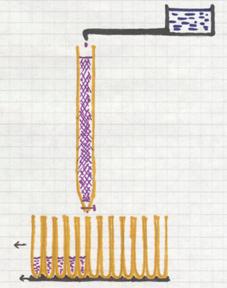
Een speciaal type van chromatografie is de kolomchromatografie. De kolom (een glazen buis) is vol met een speciale vaste stof (zand, aluminiumoxide, bepaalde gel, e.a.). Bovenop wordt een mengsel van componenten aangebracht; dat laat je in de kolom trekken en meteen open je een kraantje dat druppelsgewijs een "loopvloeistof" laat doorsijpelen. Tijdens dat doorsijpelen wordt het mengsel meegenomen naar beneden, maar wel elke component van het mengsel met zijn eigen snelheid.
Die snelheid hangt namelijk af van factoren als: hoe groot zijn de deeltjes van die component? Hoe oplosbaar is de component in de loopvloeistof? hoe goed wordt de component geabsorbeerd aan de vaste stof? enzovoort.
Om de zoveel seconden wordt er een nieuwe reageerbuis onder de kolom gezet om de vloeistof op te vangen. Aan het eind van dit proces bevat elke reageerbuis een klein beetje loopvloeistof + in sommige buizen een beetje component. Er zijn prima detectiemethoden om te kijken waar dat zit.
Opdracht 52
Leg de werking van het hiervoor genoemde apparaat in details uit.
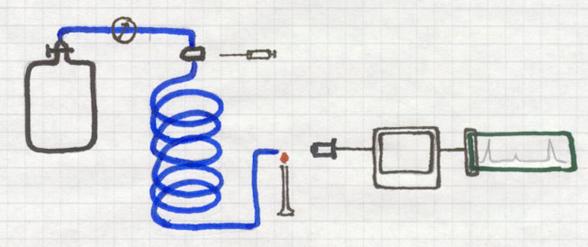
Ook gaschromatografie is een methode die absorptie toepast.
Stoffen worden geabsorbeerd door een 'drager'.
Een lange, dunne, spiraalvormig gebogen buis bevat een poreuze vaste stof, de drager. Continu passeert een (inert) gas door die buis, dus langs die drager. Het gas (zou bijvoorbeeld He kunnen zijn) is afkomstig van een cilinder waar de gasdruk heel precies wordt bijgehouden. Helium wordt er wel voor gebruikt, maar ook andere inerte (niet reagerende) gassen.
Aan het begin van de buis bevindt zich een injectiekamertje waar je een gas(mengsel) kan inspuiten. Dat onbekende gasmengsel wil je gaan onderzoeken. De ingespoten, kleine hoeveelheid daarvan wordt meteen meegenomen door het draaggas door de buis heen. De ene component zal sneller door de buis kunnen dan de ander, afhankelijk van de absorptie door de drager. Dus zal het ene gas eerder de buis verlaten dan het andere.
Aan het uiteinde kan bijvoorbeeld een microvlam staan die met een kleurverandering reageert op het naar buiten komen van een component. Een detector analiseert dan de kleur en de intensiteit van dat gas, of van de verbrandingsproducten, en zet dat om in een signaal dat geprint kan worden.
Zo kun je niet alleen bepalen welke componenten in het mengsel zaten, maar ook in welk percentage.
Opdracht 53
Leg de werking van het apparaat in details uit.
Opdracht 54
Eén van de scheidingsmechanismen van deeltjes, in kolommen, is gebaseerd op het verschil in grootte van de deeltjes.
Welke deeltjes zullen de kolom het eerst verlaten: de grootste of de kleinste?
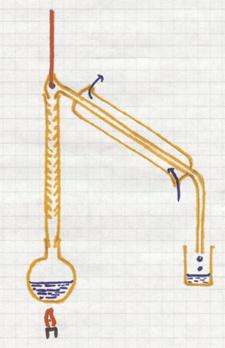
Dit is een scheidingsmethode gebaseerd op verschil in kookpunten van vloeistoffen.
Als je een mengsel van vloeistoffen verwarmt zal de vloeistof met het laagste kookpunt het eerst gaan koken en ontsnappen (verdampen) uit het mengsel. De damp zal in de condensatorbuis terecht komen, waar gekoeld wordt en waar dus deze component condenseert en wordt opgevangen.
De overige componenten, met hogere kookpunten, blijven voorlopig achter en zullen pas ontsnappen bij nog hogere temperaturen. Goede temperatuurscontrole is dus zeer nodig tijdens het proces.
voorbeeld: je kunt wijn destilleren waarbij alcohol met het laagste kookpunt (78ºC) het eerst zal ontsnappen.
een mooie afbeelding vind je op wikipedia.
Opdracht 55
Bij welke temperatuur kan men wijn destilleren om alcohol te verkrijgen?
Filtratie is alleen mogelijk met heterogene mengsels met vaste deeltjes die te groot zijn voor een filter. Ze kunnen er niet doorheen, maar de (kleinere) vloeistofdeeltjes wel.
Filters heb je in alle soorten en maten, van zeer fijn tot grof.

Je hebt duidelijk een vaste stof in een vloeistof, een heterogeen mengsel dus, en het neerslag(s) heeft redelijk zware kristallen. Je kunt dan beginnen met 'decanteren' = de vloeistof afgieten terwijl de vaste stof achterblijft.
Normaal gaat het hier om homogene mengsels. Anders zou je wel filtreren of decanteren.
Je verwarmt zo'n mengsel voorzichtig, de vloeistof verdampt en de vaste stof blijft over. Natuurlijk alleen als de vloeistof en de vaste stof er tegen kunnen verhit te worden en niet voortijdig ontleden.
Je spreekt hier ook wel van 'indampen'.

Het gaat om een homogeen mengsel van (l) + (s)
De afbeelding toont een methode om een vloeistof voorzichtig te verdampen, d.w.z. op kokend water, in een waterbad. Zo'n waterbad kan natuurlijk alleen dienst doen als temperatuur van 100ºC genoeg is om de bedoelde vloeistof te verdampen. De opgeloste (vaste) stof blijft achter in het verdampingsschaaltje.
Opdracht 56
Leg uit waarom de productie van zeezout verdamping vereist.
Centrifugeren kan alleen als het mengsel heterogeen is. Vaak is het een gemakkelijke en snellere methode dan filtreren. De deeltjes met de grootste massa, dus de vaste stof, slaan neer op de bodem van de centrifugebuis onder invloed van de middelpuntvliedende kracht (of liever: de opgewekte centrifugale kracht).
Kijk even op de volgende site.
Je past deze methode bijvoorbeeld toe als je een suspensie hebt: een troebel mengsel van (s) + (l) dat met een filter niet gescheiden wordt. (s) kan in dit geval bijvoorbeeld opgebouwd zijn uit zeer kleine kristalletjes of ook uit macromoleculen.
Er zijn wel methoden voor centrifugeren van (g) + (g). Gascentrifuges worden wel toegepast om bijv. zwaar waterstof te scheiden van gewoon waterstof (verrijking).
Elke stof bevat energie; dat kan veel zijn of weinig, maar altijd zit er chemische energie in de materie op een latente ofwel potentiële manier. Deze interne energie manifesteert zich onder bepaalde omstandigheden, namelijk als de stof meedoet aan een reactie, dus als de stof verandert.
Ter herinnering: er bestaan vele vormen van energie: stralingsenergie, kinetische energie, elektrische energie, potentiële energie, chemische energie.
Opdracht 57
Leg uit dat explosieven stoffen met heel veel energie moeten zijn.
Opdracht 58
Maak een schatting van de interne (chemische) energie van de volgende stoffen en plaats ze in oplopende energie-inhoud: benzine, water, TNT, waterstof, kooldioxide, natriumchloride, zwavel, hout, suiker.
De mens moet eten. Dieren natuurlijk ook, maar voor het gemak beperken we ons maar even tot onszelf. Het menselijk lichaam kan niet zonder eten, haalt energie uit voeding. Eiwitten zijn meer voor de groei en het onderhoud van weefsel, maar suikers en vetten nemen we vooral voor de voor energie.
Opdracht 59
Welke voedingsstoffen nemen we in Europa dagelijks het meest in om energie te hebben voor onze activiteiten?
Opdracht 60
In ons lichaam worden die energierijke stoffen omgezet in produkten. Betreft het hier exotherme of endotherme reacties?
Leg je antwoord uit.
Antwoord 05-60
Als je energie toevoert aan een stof zal die stof - normaal gesproken - warmer worden. De deeltjes verkrijgen meer beweging!
Alleen als die energietoevoer gepaard gaat met verandering van fase is er (tijdelijk) iets anders aan de hand: bij deze overgang wordt de energie gebruikt om de deeltjes verder van elkaar te verwijderen of om het rooster stuk te maken. De temperatuur blijft gelijk zolang twee fasen allebei nog bestaan.
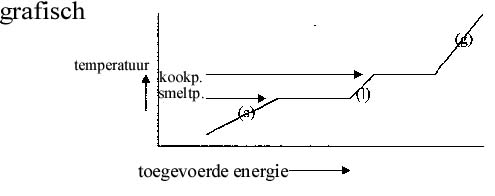
Even een opmerking tussendoor:
De opwarming van de aarde betekent dat de enorme ijsvoorraden gaan smelten. Tijdens het smelten blijft de temperatuur min of meer constant. Maar zodra het meeste ijs gesmolten is, gaat de temperatuur versneld omhoog. Als we dat gaan meemaken.... waar moeten we dan schuilen?
Opdracht 61
Wat zijn de uiterste waarden in die grafiek? D.w.z. tot welk minimum en tot welk maximum gaat de temperatuur?
Welke conclusies trek je daaruit?
De elementen die bij verbranding erg belangrijk zijn, zijn waterstof en koolstof, met als eindprodukten: water en koolzuurgas (CO2).
Water wordt gevormd bij de verbranding van Waterstof en koolzuurgas bij de verbranding van koolstof.
Steenkool bevat erg veel koolstof en aardgas relatief meer waterstof.
Opdracht 62
Wat is voor het milieu beter: verbranding van steenkool of verbranding van aardgas?
Als koolwaterstoffen verbrand worden, reageren dus die twee elementen H en C met zuurstof. Let op: Waterstof is de fanatiekste reageerder, dus verbruikt als eerste het zuurstof. Als er genoeg zuurstof over is, komt daarna het koolstof aan de beurt. Bij tekort aan zuurstof vormt zich koolmonoxide (CO) of zie je zwarte walmen van roet (onverbrande koolstof) ontstaan.
De vorming van CO2 vindt al vele jaren in gigantische hoeveelheden plaats over de hele wereld en wordt gezien als de oorzaak van de opwarming van de aarde en dus ook van de stijging van de zeespiegel. Op termijn kan dit een zeer gevaarlijke situatie opleveren, waar snel iets aan gedaan moet worden. Anders zullen veel Nederlanders in de toekomst asiel in andere landen moeten gaan zoeken.
Opdracht 63
Op welke manieren draagt Europa bij aan de toename van CO2 in de atmosfeer?
Ethanol (alcohol) kan in grote hoeveelheden gemaakt worden, bijvoorbeeld uit suikerriet dat men laat gisten.
Biogas is een mengsel van gassen (met relatief veel methaan) dat gevormd wordt bij de bacteriële gisting van rioolprodukten. (stront dus bijvoorbeeld)
Waterstof kun je maken in een elektrolyseproces. Dat kost helaas nogal veel energie, dus wat heb je er dan aan. Als je eerst energie moet opwekken met aardgas om vervolgens met die energie waterstof te maken, dat schiet niet op. Er moet nog heel veel onderzoek gedaan worden naar de beste manier om waterstof in grote hoeveelheden te maken.
Er zijn wel ideeën. We zouden misschien iets kunnen leren van de planten: fotosynthese. Bij dat proces wordt onder invloed van zonlicht water gesplitst in waterstof en zuurstof. En dat zou toch wel zo'n mooi mengsel zijn om vervolgens weer energie op te wekken, zonder dat er koolzuurgas bij gevormd wordt.
Het gerucht gaat dat enkele universiteiten al ver zijn in het ontwikkelen van kunstmatig bladgroen. Dat zou dan aangebracht worden in bladgroenpanelen, die - net als gewone zonnepanelen - licht vangen en omzetten in ..... Ja, dat zou direct stroom kunnen zijn, maar waarschijnlijker is dat er waterstof bij gevormd wordt.
Verder kunnen we natuurlijk de windmolens, juist op momenten dat die veel stroom leveren op tijden dat er weinig gebruikt wordt ('s nachts bijvoorbeeld) die stroom allemaal gebruiken voor elektrolyse van zeewater. Dit levert grote hoeveelheden waterstof op.
Opdracht 64
Waterstof zou de beste brandstof zijn. Waarom?
Er zijn alternatieve, niet scheikundige, bronnen voor energie: kernenergie, waterkrachtenergie, windenergie, zonne-energie.
Batterijen en accu's hebben als functie om elektrische energie te leveren. Dus moet er energie in zitten en die energie noemen we "chemische energie".
De stoffen in batterijen en accu's moeten dus energierijke stoffen zijn, anders heb je er niets aan.
Benzine is een energierijke stof, maar die zul je in batterijtjes niet tegenkomen. Er worden andere stoffen voor gebruikt die netjes op hun plaats blijven en niet zo gevaarlijk zijn.
In module 7 zullen we verder ingaan op stoffen die energierijk zijn en hoe ze hun energie vrijgeven tijdens chemische reacties.
In module 10 kun je iets lezen over de zogenaamde oxidatoren en reductoren, stoffen die in batterijen en accu's zitten.
Bij accu's en batterijen wordt tijdens reacties chemische energie omgezet in elektrische energie.
Een "lege" batterij is niet letterlijk leeg. In een lege batterij zijn de energierijke stoffen "op"; ze zijn omgezet in energie-arme stoffen.
Opladen van de (oplaadbare) batterij is een proces waarin de energierijke stoffen weer worden teruggevormd.
 dus de massa van één molecuul water is 18 a.m.e.
dus de massa van één molecuul water is 18 a.m.e.
 een lagere temperatuur dan de minimumtemperatuur bestaat niet = 0 K (= -273ºC)
een lagere temperatuur dan de minimumtemperatuur bestaat niet = 0 K (= -273ºC)
 dus de massa van één molecuul water is 18 a.m.e.
dus de massa van één molecuul water is 18 a.m.e.

 1 gram = 1/249,6 MOL
1 gram = 1/249,6 MOL
 4 gram = 4 x 1/249,6 MOL = 0,016 MOL
4 gram = 4 x 1/249,6 MOL = 0,016 MOL
 5 ml weegt 5 x 0,8 gram (= 4 gram).
5 ml weegt 5 x 0,8 gram (= 4 gram).
 1 liter (=1000 ml) moet dan dus 10 x zoveel bevatten = 40 gram alcohol [dat is al genoeg om heel wat hersencellen in hun groei te remmen!!]
1 liter (=1000 ml) moet dan dus 10 x zoveel bevatten = 40 gram alcohol [dat is al genoeg om heel wat hersencellen in hun groei te remmen!!]
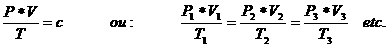






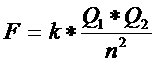
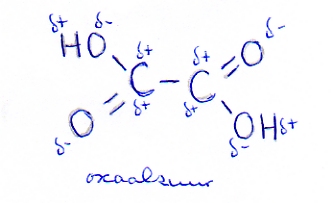
 (l)
(l) (s)
(s) (g)
(g) (l)
(l) (g)
(g) (g)
(g) (s)
(s) H2O(l)
H2O(l)
 C8H18(g)
C8H18(g)
 Pb(l)
Pb(l)




 2CaSO4.2H2O(s)
2CaSO4.2H2O(s)










